
科目: 来源: 题型:解答题
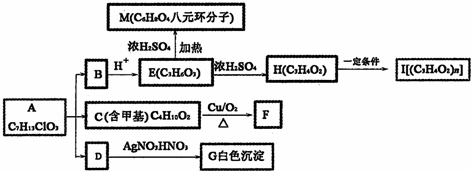
 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$ +2H2O;②E→M:2HOCH2CH2COOH$→_{△}^{浓H_{2}SO_{4}}$
+2H2O;②E→M:2HOCH2CH2COOH$→_{△}^{浓H_{2}SO_{4}}$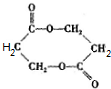 +2H2O;
+2H2O;查看答案和解析>>
科目: 来源: 题型:解答题
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
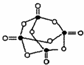 所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH
所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH (PAN)等二次污染物.
(PAN)等二次污染物.查看答案和解析>>
科目: 来源: 题型:选择题

| 选项 | 操作 | 现象 | 结论 |
| A | ①将湿润的红色石蕊试纸靠近试管口 | 试纸不变色 | NH4Cl受热不分解 |
| B | ②将铜丝向下移动使其与浓硝酸接触 | 产生红棕色气体,用排水法收集气体 | 可以用该装置制备NO2 |
| C | ③光照 | 试管颜色变浅,出现油状滴液,少量白雾 | 甲烷与氯水发生取代反应 |
| D | 打开分液漏斗 | 右侧试管中出现白色沉淀 | 酸性:HNO3>H2CO3>H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 25℃时,Mg(OH)2固体在20mL 0.01mol/L的氨水中的Ksp比在20mL0.01mol/L NH4Cl溶液中的Ksp小 | |
| D. | 25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | -69.4kJ•mol-1 | B. | -45.2kJ•mol-1 | C. | +69.4kJ•mol-1 | D. | +45.2kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
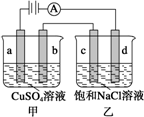
| A. | 向乙中加入适量盐酸,溶液组成可以恢复 | |
| B. | 电解时向乙中滴入酚酞溶液,c电极附近变红 | |
| C. | 当b极有64gCu析出时,c电极产生2g气体 | |
| D. | 甲中a极上的电极反应式为:4OH--4e-=O2↑+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 体系压强保持不变 | B. | 混合气体颜色保持不变 | ||
| C. | SO3与NO的体积比保持不变 | D. | 每消耗1molSO2,同时生成1molNO |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氨水使湿润的红色石蕊试纸变蓝:NH3•H2O?NH4++OH- | |
| B. | 工业上用过量的NaOH溶液吸收:SO2:SO2+OH-=HSO3- | |
| C. | 用烧碱溶液清洗铝表面的氧化膜:2OH-+Al2O3=2AlO2-+H2O | |
| D. | 用石灰乳吸收泄露的氯气:Ca(OH)2+Cl2=Ca2++Cl-+ClO-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com