
科目: 来源: 题型:选择题
| A. | 生物质能来源于植物及其加工产品所贮存的能量,绿色植物通过光合作用将化学能转化为生物质能 | |
| B. | 用氨水法处理燃煤烟气中的二氧化硫,即可消除其污染,又可得到副产品硫酸铵 | |
| C. | 某小组研究人员成功制备出了四氧化铱正离子(IrO4+),其球棍模型为 ,由此可判断其中铱元素显+9价 ,由此可判断其中铱元素显+9价 | |
| D. | 门捷列夫根据元素性质随元素的相对原子质量递增而显现元素周期性变化的规律排出了第一张元素周期表 |
查看答案和解析>>
科目: 来源: 题型:填空题

 可写成
可写成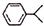
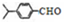 ,上述合成路线中①属于加成反应;
,上述合成路线中①属于加成反应;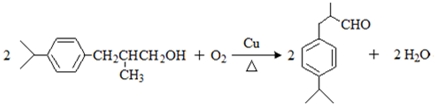 .
.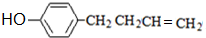 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Si、P、S元素的最高正价依次降低 | |
| B. | Li、Na、K的原子半径依次增大 | |
| C. | C、O、N的原子半径依次减小 | |
| D. | Na、Mg、Al原子的最外层电子数依次减少 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NA代表阿伏加德罗常数,1molC4H10中含共价键数目为14NA | |
| B. | 某反应的△H=-88kJ•mol-1,则正反应活化能一定小于88kJ•mol-1 | |
| C. | 已知某温度下,Kw=l×10-13,若将pH=8的NaOH溶液与pH=5的H2SO4溶液混合保持温度不变,欲使混合溶液pH=7,则NaOH溶液与H2SO4溶液的体积比为11:9 | |
| D. | 将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,电离度和Ka(HF)保持不变,$\frac{c({F}^{-})}{c({H}^{+})}$始终保持增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 因为铝原子比钠原子失去电子数目多,所以铝比钠的还原性强 | |
| B. | 某微粒的结构示意简图为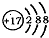 ,则该元素在周期表中位于第三周期、VIA族 ,则该元素在周期表中位于第三周期、VIA族 | |
| C. | Be(OH)2的碱性比Mg(OH)2的碱性强 | |
| D. | 原子半径:Na>Si>O |
查看答案和解析>>
科目: 来源: 题型:解答题
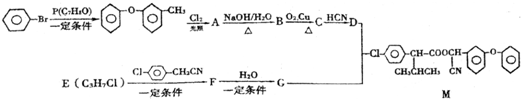
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
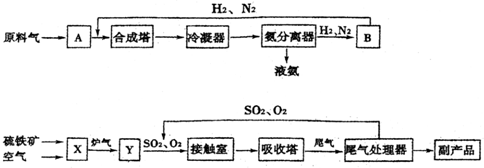
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④⑤ | B. | ②③④ | C. | ①②③ | D. | ①②③④⑤ |
查看答案和解析>>
科目: 来源: 题型:解答题
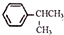
 ,已知B、C、D、E、F五种烃有如下转化关系,B为苯的同系物,最多只有13个原子处于同一平面上,D中所有的原子一定在同一平面上.
,已知B、C、D、E、F五种烃有如下转化关系,B为苯的同系物,最多只有13个原子处于同一平面上,D中所有的原子一定在同一平面上.
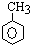 +3H2$→_{△}^{Ni}$
+3H2$→_{△}^{Ni}$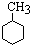
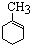 _
_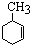
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com