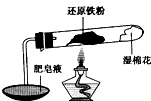
在高温条件下铁与水能发生反应.资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570℃时,生成Fe0,高于570℃时,生成Fe
30
4.老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.
(1)实验中使用肥皂液的作用是
检验反应中生成的H2
检验反应中生成的H2
.
(2)甲同学为探究实验后试管内的固体X中含有哪些物质,进行了下列实验.
| 实验编号 |
实验操作 |
实验现象 |
| ① |
取少量黑色粉末X放入试管1中,加入盐酸,微热 |
黑色粉末逐渐溶解,溶液呈黄绿色;有少量气泡产生 |
| ② |
向试管1中滴加几滴KSCN溶液,振荡 |
溶液没有出现血红色 |
根据上述实验,能确定固体中存在的物质是
Fe
Fe
;不能确定是否存在Fe0的原因是
铁与盐酸反应生成了氯化亚铁,或者 Fe3O4溶于盐酸生成的Fe3+与Fe反应生成了Fe2+
铁与盐酸反应生成了氯化亚铁,或者 Fe3O4溶于盐酸生成的Fe3+与Fe反应生成了Fe2+
.
(3)乙同学设计下列实验方案以确定实验后试管内的固体中是否存在FeO.
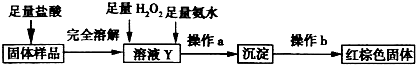
确定是否存在Fe0需要测定并记录的实验数据是
固体样品质量和红褐色固体的质量(其他合理答案也可)
固体样品质量和红褐色固体的质量(其他合理答案也可)
.


 铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
铁及其化合物在生活、生产中有广泛应用.请回答下列问题:


 在高温条件下铁与水能发生反应.资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570℃时,生成Fe0,高于570℃时,生成Fe304.老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.
在高温条件下铁与水能发生反应.资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570℃时,生成Fe0,高于570℃时,生成Fe304.老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.
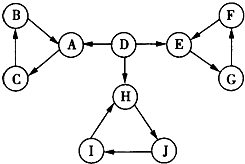 已知部分常见物质转化时,可以存在如图所示的三角转化关系.已知图中每个小三角形内的三种物质至少含有第三周期中的一种相同元素,且图示中所有物质均由短周期元素组成.D为能助燃的气体单质;E为酸性氧化物,能与酸反应,F不溶于水.H为淡黄色固体化合物,电解饱和J溶液是工业上的重要反应.C为离子化合物,阴、阳离子均含有金属元素.
已知部分常见物质转化时,可以存在如图所示的三角转化关系.已知图中每个小三角形内的三种物质至少含有第三周期中的一种相同元素,且图示中所有物质均由短周期元素组成.D为能助燃的气体单质;E为酸性氧化物,能与酸反应,F不溶于水.H为淡黄色固体化合物,电解饱和J溶液是工业上的重要反应.C为离子化合物,阴、阳离子均含有金属元素.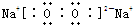
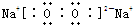
 A、B、C、D、E五种化合物均含有同一种短周期常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E易溶于水.若取A溶液灼烧,焰色反应为紫色(透过蓝色钴玻璃片).
A、B、C、D、E五种化合物均含有同一种短周期常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E易溶于水.若取A溶液灼烧,焰色反应为紫色(透过蓝色钴玻璃片).