
科目: 来源: 题型:解答题
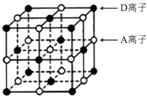 A、B、C、D为短周期主族元素,原子序数依次增大.A和D可形成化合物E,E的焰色反应呈黄色;B是地壳中含量最高的金属元素;C基态原子最外层原子轨道中有两个未成对电子且无空轨道.请回答下列问题:
A、B、C、D为短周期主族元素,原子序数依次增大.A和D可形成化合物E,E的焰色反应呈黄色;B是地壳中含量最高的金属元素;C基态原子最外层原子轨道中有两个未成对电子且无空轨道.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| 溶液 | X | Y | Z | W |
| pH | 12 | 2 | 7.7 | 5.6 |
| A. | 将Z溶液加水稀释至浓度为0.001mol/L,所得溶液pH=6.7 | |
| B. | 四种溶液中,水的电离程度最大的是W溶液 | |
| C. | 将X、W溶液按1:2的体积比混合,所得溶液中:c(H+)>c(OH-) | |
| D. | 将11mLX溶液与9mLY溶液混合(忽略混合时体积的变化),所得溶液pH=10 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 序号 | 实验内容 | 实验目的 |
| A | 向盛有10滴0.1 mol•L-1AgNO3溶液的试管中滴加0.1mol•L-1 NaCl溶液,至不再有沉淀生成,再向其中滴加0.1mol•L-1 Na2S溶液 | 证明AgCl能转化为溶解度更小的Ag2S |
| B | 取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 证明该溶液中一定含有大量的SO42- |
| C | 向某卤代烃中加入NaOH溶液,加热一段时间后,加入AgNO3溶液 | 检验卤代烃中的卤素原子 |
| D | 向纯碱中滴加足量盐酸,将产生的气体通入苯酚钠溶液 | 证明酸性:盐酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2SiO3溶液中滴加适量稀HCl制硅酸胶体:SiO32-+2H+═H2SiO3(胶体) | |
| B. | 用稀HNO3清洗试管壁上的银镜:3Ag+4H++NO3-═3Ag++NO↑+2H2O | |
| C. | (NH4)2SO4溶液与过量Ba(OH)2溶液混合:NH4++SO42-+Ba2++OH-═BaSO4↓+NH3•H2O | |
| D. | SO2通入氯水中:Cl2+SO2+2H2O═SO42-+2Cl-+4H+ |
查看答案和解析>>
科目: 来源: 题型:选择题
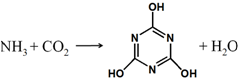 CO2的资源化利用是解决温室效应的重要途径,如图是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应.下列有关三聚氰酸的说法正确的是( )
CO2的资源化利用是解决温室效应的重要途径,如图是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应.下列有关三聚氰酸的说法正确的是( )| A. | 分子式为C3H6N3O3 | B. | 分子中既含有σ键又含有π键 | ||
| C. | 分子中既含极性键,又含非极性键 | D. | 生成该物质的上述反应为中和反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫酸铁可用作净水剂 | B. | 二氧化硅可用作计算机芯片 | ||
| C. | 铜制容器可用于盛装浓硝酸 | D. | 醋酸铅可用于分离提纯蛋白质 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 弱酸 | H2CO3 | 水杨酸(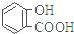 ) ) |
| 电离平衡常数(25℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-13 |
| A. | 常温下,等浓度、等体积的NaHCO3 溶液pH小于 溶液pH 溶液pH | |
| B. | 常温下,等浓度、等体积的Na2 CO3 溶液和 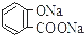 溶液中所含离子总数前者小于后者 溶液中所含离子总数前者小于后者 | |
| C. | 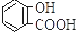 +2NaHCO3→ +2NaHCO3→ +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键 |
查看答案和解析>>
科目: 来源: 题型:选择题
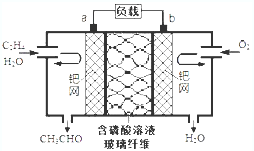 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,下列说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,下列说法正确的是( )| A. | 每有0.1mol O2反应,则迁移H+0.4mol | |
| B. | 正极反应式为:CH2=CH2-2e-+2OH-=CH3CHO+H2O | |
| C. | 电子移动方向:电极a→磷酸溶液→电极b | |
| D. | 该电池为可充电电池 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Al14有42个价电子,且与IIA族元素性质相似 | |
| B. | Al13有39个价电子,且与卤素性质类似 | |
| C. | Al13在气相中与HI反应可生成HAl13I,且化学方程式为 Al13+HI=HAl13I | |
| D. | Al13原子中A1原子间是通过离子键结合的 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com