
科目: 来源: 题型:填空题
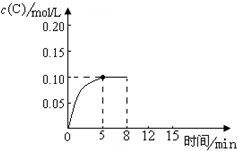 在500℃时,将足量的A固体投入2.0L真空密闭容器中,发生A(s)═2B(g)+C(g)反应,测得气体C随时间的浓度变化如图所示
在500℃时,将足量的A固体投入2.0L真空密闭容器中,发生A(s)═2B(g)+C(g)反应,测得气体C随时间的浓度变化如图所示查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃\CO的体积分数%\投料比 | $\frac{n({H}_{2}O)}{n(CO)}$=1 | $\frac{n({H}_{2}O)}{n(CO)}$=3 | $\frac{n({H}_{2}O)}{n(CO)}$=5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
查看答案和解析>>
科目: 来源: 题型:选择题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2min的平均速率ν(Z)=2.0×10-5 mol/(L•min) | |
| B. | 4min时,ν(逆)>ν(正) | |
| C. | 该温度下,此反应的平衡常数K=1.44 | |
| D. | 7min时,反应还未达到平衡状态 |
查看答案和解析>>
科目: 来源: 题型:解答题
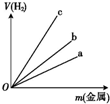 氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.
氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.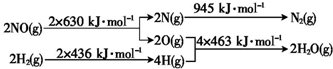
查看答案和解析>>
科目: 来源: 题型:多选题
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol•L-1) | 0.8 | 1.24 | 1.24 |
| A. | 平衡后升高温度,平衡常数>400 | |
| B. | 平衡时,c(CH3OCH3)=1.6 mol•L-1 | |
| C. | 平衡时,反应混合物的总能量减少40 kJ | |
| D. | 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使用催化剂 | B. | 增大A物质的浓度 | C. | 增大B物质的浓度 | D. | 减少C物质的浓度 |
查看答案和解析>>
科目: 来源: 题型:多选题
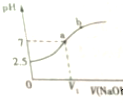 常温下,在10mL 0.1mol•L-1 NaHSO3溶液中逐滴滴加0.1mol•L-1 NaOH溶液,反应过程中溶液pH变化如图所示,下列说法不正确的是( )
常温下,在10mL 0.1mol•L-1 NaHSO3溶液中逐滴滴加0.1mol•L-1 NaOH溶液,反应过程中溶液pH变化如图所示,下列说法不正确的是( )| A. | NaHSO3溶液呈酸性 | B. | V1<10mL | ||
| C. | 在a点,c(Na+)=c(SO32- )+c(HSO3-) | D. | HSO3-的电离常数Ka=6.25×10-7 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com