
科目: 来源: 题型:选择题
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | A的单质能将E单质从HE的溶液中置换出来 | |
| B. | A、H、J的离子半径由大到小顺序是A>J>H | |
| C. | G元素的单质不存在同素异形体 | |
| D. | I在DB2中燃烧生成两种化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{W(m-n)}{m}$mol | B. | $\frac{W(m-n+2)}{m}$mol | C. | $\frac{W(m-n-2)}{m}$mol | D. | $\frac{m-n-2}{Wm}$mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的酸性逐渐增强,说明F、Cl、Br、I的非金属性逐渐增强 | |
| B. | 元素R最高正价为+7价,表明R元素一定是ⅦA族元素 | |
| C. | 从元素在周期表中的位置可以推断,硅和锗都可用作半导体材料 | |
| D. | 若M+和R2-具有相同的电子层结构,则原子半径:M<R |
查看答案和解析>>
科目: 来源: 题型:解答题

 .
.查看答案和解析>>
科目: 来源: 题型:选择题
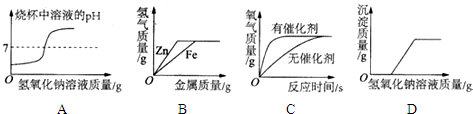
| A. | 向盐酸中逐渐滴加氢氧化钠溶液 | |
| B. | 向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉 | |
| C. | 用等质量、等浓度的过氧化氢溶液在有无催化剂条件下制氧气 | |
| D. | 向一定质量氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
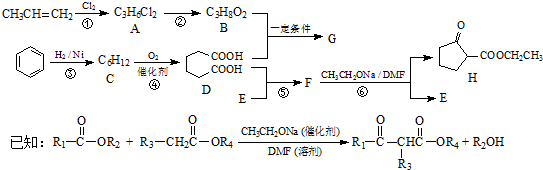
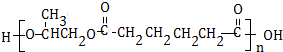 .
.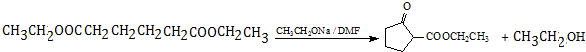 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
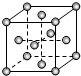 X、Y、Z、R为短周期元素且原子序数依次增大.X、R原子核外电子层数等于其最外层电子数,且原子半径X<Y,Y元素的基态原子中电子分布在3个不同的能级,且每个能级中的电子总数相同;Z 的两种同素异形体都存在于大气中,对生命起着重要作用.另有M元素位于周期表的第4周期第6列.请回答下列问题:
X、Y、Z、R为短周期元素且原子序数依次增大.X、R原子核外电子层数等于其最外层电子数,且原子半径X<Y,Y元素的基态原子中电子分布在3个不同的能级,且每个能级中的电子总数相同;Z 的两种同素异形体都存在于大气中,对生命起着重要作用.另有M元素位于周期表的第4周期第6列.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液,再水浴加热 | 无银镜生成 | 淀粉未发生水解 |
| B | 将一铝箔放在酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面生成致密的Al2O3薄膜,且Al2O3熔点高于Al |
| C | 铜放入稀硫酸中,再加入硝酸钠固体 | 开始无明显现象,后溶液变蓝,有明显的气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
| D | 向2 mL 0.1 mol/L Na2S溶液中滴几滴0.1 mol/L ZnSO4溶液;再加入几滴0.1 mol/L CuSO4溶液 | 先生成白色沉淀,后生成黑色沉淀 | 溶度积(Ksp):ZnS>CuS |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com