
科目: 来源: 题型:选择题
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g/100g) | 74 | 0.00084 | 0.01 |
| A. | 已知MgCO3的KSp=6.82×10-6mol2•L-2,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6mol2•L-2 | |
| B. | 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 | |
| C. | 将表中三种物质分别与水混合,分别加热、灼烧,最终的固体产物相同 | |
| D. | 用足量石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 除去(NH4)2CO3溶液中含有的少量NH4HCO3杂质的方法是加入NaOH溶液 | |
| B. | 将混有HCl的Cl2通入饱和NaHCO3溶液中不能得到纯净的氯气 | |
| C. | 向两份Fe2O3的固体中分别加入HCl溶液与HI溶液,二者反应现象相同 | |
| D. | 向固体中加入足量的浓HNO3加热,能得到使澄清石灰水变浑浊的气体,证明该固体中一定存在CO32-或HCO3- |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

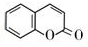

 的化学方程式(无机试剂任选)
的化学方程式(无机试剂任选)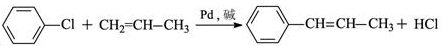 、
、 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 14gC2H4中含有2m个C-H键 | |
| B. | 1mol.L-1 NH3•H2O溶液中含有nA个NH4+ | |
| C. | 1molNa2O2和足量CO2反应产生nA个O2分子 | |
| D. | 常温常压下,22.4L的SO2中含有nA个SO2分子 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 热化学方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| ①2H2(g)+CO(g)?CH3OH(g)△H1=a kJ•mol-1 | 2.5 | 0.2 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g)△H2=b kJ•mol-1 | 1.0 | 2.3 |
| ③3H2(g)+CO2 (g)?CH3OH(g)+H2O(g)△H3=c kJ•mol-1 | K3 | 4.6 |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO和 N2为等电子体,22.4L的CO气体和1mol N2所含的电子数相等 | |
| B. | 1L密度为1.84g•cm-3质量分数为98%的硫酸溶液中,所含氢原子数为36.8NA | |
| C. | 在标准状况下,32g氧气和臭氧的混合气体中含氧原子数为2NA | |
| D. | 在标准状况下,30g福尔马林和22.4L三氧化硫所含氧原子数之比为1:3 |
查看答案和解析>>
科目: 来源: 题型:解答题
 甲烷、甲醇、CO、H2、CO2均是重要的化工原料.
甲烷、甲醇、CO、H2、CO2均是重要的化工原料.查看答案和解析>>
科目: 来源: 题型:解答题
 某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g).经过5min后,反应达到平衡,此时转移电子6mol.
某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g).经过5min后,反应达到平衡,此时转移电子6mol.查看答案和解析>>
科目: 来源: 题型:解答题
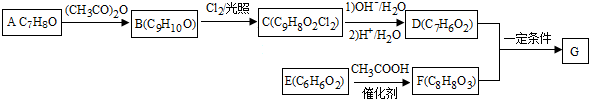

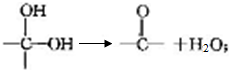

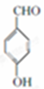
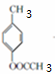 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$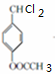 +2HCl反应类型为取代反应,1molC与足量NaOH溶液反应,消耗4molNaOH
+2HCl反应类型为取代反应,1molC与足量NaOH溶液反应,消耗4molNaOH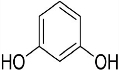 +CH3COOH$\stackrel{催化剂}{→}$
+CH3COOH$\stackrel{催化剂}{→}$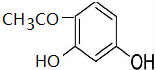 +H2O
+H2O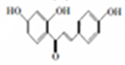
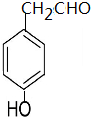 (填结构简式)
(填结构简式)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com