
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酸性强弱:HIO4>HBrO4>HClO4 | B. | 原子半径大小:Na>Mg>Al | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 金属性强弱:Na>Mg>Al |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SO2使溴水褪色,显示了SO2的漂白性 | |
| B. | SO2使溴水褪色,显示了SO2的还原性 | |
| C. | 从溴水中提取单质溴,可以用乙醇进行萃取 | |
| D. | SO2是形成酸雨的唯一污染物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | Mg(OH)2碱性比Ca(OH)2强 | |
| C. | PH3比HF稳定 | |
| D. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 |
查看答案和解析>>
科目: 来源: 题型:解答题
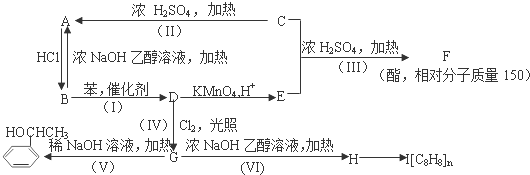
 ;I
;I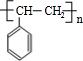 .
. .
. .
.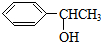 的同分异构体甚多,其中属于酚的同分异构体共有9种,这些同分异构体中,在核磁共振氢谱中有四个吸收峰的同分异构体的结构简式为:
的同分异构体甚多,其中属于酚的同分异构体共有9种,这些同分异构体中,在核磁共振氢谱中有四个吸收峰的同分异构体的结构简式为: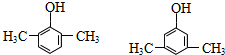 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH4 | B. | PCl3 | C. | SiCl4 | D. | XeF4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在CH2=CH2分子中,存在五个s-sp2σ键和一个π键 | |
| B. | N、O、F电负性大小:F>O>N;第一电离能大小:F>O>N | |
| C. | 酸性强弱:H2SO4>H2SO3>H2SeO3;岩浆晶出的先后顺序:SiO2、MgSiO3、CaSiO3 | |
| D. | 在共价化合物中,一定存在极性共价键,可能存在非极性共价键,一定不存在离子键 |
查看答案和解析>>
科目: 来源: 题型:选择题
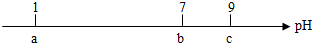
| A. | 常温下,0.1mol•L-1的HCl溶液的pH=1 | |
| B. | 当pH=7时,所加NH3•H2O溶液的体积大于10mL | |
| C. | 当7<pH<9时,溶液中c(NH4+)>c(Cl-) | |
| D. | 继续滴加0.1mol•L-1的NH3•H2O溶液,溶液的pH最终可以变化至13 |
查看答案和解析>>
科目: 来源: 题型:选择题
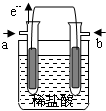 某研究小组提出了一种新的设想:利用原电池原理,设计一种H2、Cl2燃料电池,原电池总反应为:H2+Cl2=2HCl,在对外提供电能的同时还可得到工业上具有重要用途的较浓的盐酸.他们设计的原电池装置如下,其中两个电极均为多孔铂电极.下列有关叙述不正确的是( )
某研究小组提出了一种新的设想:利用原电池原理,设计一种H2、Cl2燃料电池,原电池总反应为:H2+Cl2=2HCl,在对外提供电能的同时还可得到工业上具有重要用途的较浓的盐酸.他们设计的原电池装置如下,其中两个电极均为多孔铂电极.下列有关叙述不正确的是( )| A. | a为负极,通入的气体为氢气 | |
| B. | 正极的电极反应式为:Cl2+2e-=2Cl- | |
| C. | 电流由b极流出,经外电路到a极 | |
| D. | 原电池内部,H+移向负极,Cl-移向正极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com