
科目: 来源: 题型:解答题
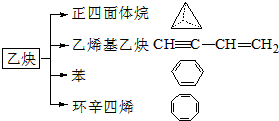

 、
、 .
.查看答案和解析>>
科目: 来源: 题型:选择题
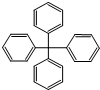
| A. | 分子式为C25H20 | |
| B. | 分子中所有原子有可能处于同一平面 | |
| C. | 该化合物分子中所有原子不可能处于同一平面 | |
| D. | 分子中处于同一平面的原子最多23个 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X为负极,Y为正极 | |
| B. | 该电池工作时,X极附近溶液的碱性增强 | |
| C. | 在标准状况下,通入5.6LO2完全反应后,有1mol电子发生转移 | |
| D. | 工作一段时间后,KOH的物质的量减少 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 储氢、释氢过程均无能量变化 | |
| B. | NaHCO3只含离子键 | |
| C. | 储氢过程中,NaHCO3被还原 | |
| D. | 释氢过程中,每消耗0.1molH2O放出2.24L的H2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 温度升高,正、逆反应速率都增大 | |
| B. | 化学反应的速率和限度均可通过改变化学反应条件而改变 | |
| C. | 氢气和氧气化合生成水和水的电解是可逆反应 | |
| D. | 化学反应达到平衡状态时,正反应速率与逆反应速率相等 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
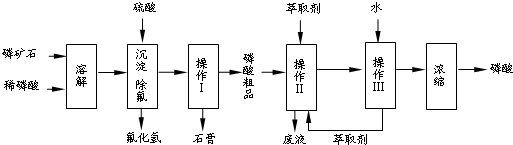
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | 熔点/℃ | 化学性质 |
| H2C2O4 | 189.5℃ | 二元弱酸,有毒,具有腐蚀性,易溶于水,100℃开始升华,157℃时开始分解,与浓硫酸混合加热会产生CO2、CO和H2O.草酸钙和草酸氢钙均为白色不溶物 |
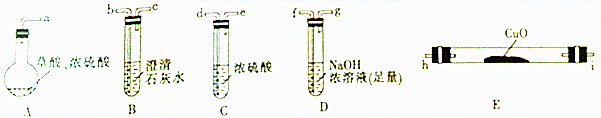
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| Ⅰ | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅱ | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅲ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
科目: 来源: 题型:解答题
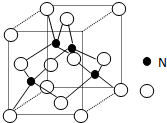 某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于陶瓷工业等领域
某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于陶瓷工业等领域查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com