
科目: 来源: 题型:选择题
| A. | 开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料 | |
| B. | 研究采煤、采油新技术,提高产量以满足工业生产的快速发展 | |
| C. | 在农村推广使用沼气 | |
| D. | 减少资源消耗、增加资源的重复使用和资源的循环再生 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
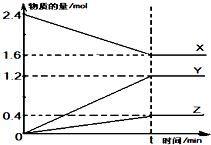 在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.
在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.查看答案和解析>>
科目: 来源: 题型:解答题
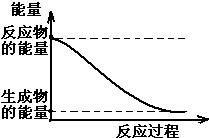 (1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热.(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填
(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热.(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 正反应生成NO2的速率和逆反应生成O2的速率相等 | |
| B. | N2O4和NO2的浓度相等 | |
| C. | 混合气体的颜色保持不变 | |
| D. | 单位时间内生成1mol O2的同时,生成1molNO |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com