
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
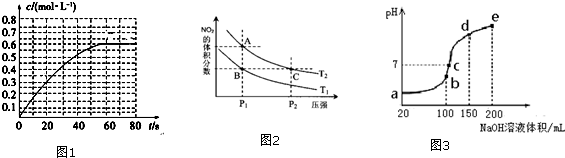
 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.请回答下列问题:
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
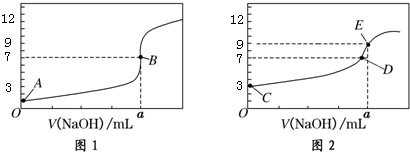
| A. | 图1是滴定CH3COOH 溶液的曲线 | |
| B. | 图2若用甲基橙作指示剂达到滴定终点时,则溶液由黄色变为红色 | |
| C. | 点D所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 如果C、E两点对应的pH分别为3、9,则水电离的氢离子浓度之比为1:100 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Al箔插入稀HNO3中无现象因Al箔表面被HNO3氧化,形成致密的氧化膜 | |
| B. | “硝基苯制备”实验中,将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触 | |
| C. | “中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,必须干燥或润洗后方可使用 | |
| D. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫酸钠溶液和醋酸铅溶液均能使蛋白质变性 | |
| B. | 金属腐蚀的本质是金属原子失电子被氧化的过程 | |
| C. | 工业生产玻璃、水泥、陶瓷,均需要用石灰石为原料 | |
| D. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol•L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) | |
| D. | 常温下,向0.1 mol•L-1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的10倍 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将某无色气体通入品红溶液中,品红溶液褪色,则此气体一定是SO2 | |
| B. | 取少许某溶液并滴加数滴硫氰化钾溶液,无明显现象,再滴加数滴H2O2溶液,溶液变血红色,则原溶液中一定含Fe2+ | |
| C. | 在硫酸钡沉淀中加入浓碳酸钠溶液充分搅拌后,取沉淀(洗净)放入盐酸中有气泡产生,说明Ksp(BaCO3)<Ksp(BaSO4) | |
| D. | 在淀粉溶液中加入稀硫酸并加热片刻再加入适量银氨溶液,水浴加热后没有银镜生成,说明淀粉没有水解 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4.4g二氧化碳中含有的共用电子对数为0.4NA | |
| B. | 用二氧化硅制取单质硅时,当生成2.24 L气体(标准状况)时,得到2.8 g硅 | |
| C. | 标准状况下,0.5NA 个NO和0.5NA 个O2混合气体的体积约为22.4 L | |
| D. | 常温时0.1 mol•L-1 硝酸铵溶液中,NH4+和H+总数一定大于0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com