
科目: 来源: 题型:选择题
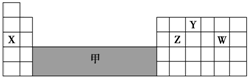
| A. | 可在灰色区域“甲”中寻找半导体材料 | |
| B. | X、Z、W 最高价氧化物对应的水化物之间两两能相互反应 | |
| C. | 气态氢化物的稳定性:Z<W | |
| D. | X只能形成一种氧化物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na、Mg、Al原子最外层电子数依次减少 | |
| B. | C、N、O元素非金属性依次增强 | |
| C. | C、N、O元素最高正价依次增大 | |
| D. | Li、Na、K的金属性依次减弱 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cu2+、Mg2+、SO42- | B. | H+、Mg2+、CO32- | C. | Ag+、NO3-、Cl- | D. | Fe2+、H+、NO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | O2、O3互为同位素 | |
| B. | 1H、2H、3H、H+、H2是氢元素形成的五种不同粒子 | |
| C. | 正丁烷和异丁烷互为同素异形体 | |
| D. | 金刚石、C60互为同分异构体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 大量使用化肥和农药,以提高农作物产量 | |
| C. | 不随意丢弃旧电池,生活垃圾分类放置 | |
| D. | “绿色化学”的核心是使原料尽可能全部转化为目标产物 |
查看答案和解析>>
科目: 来源: 题型:解答题
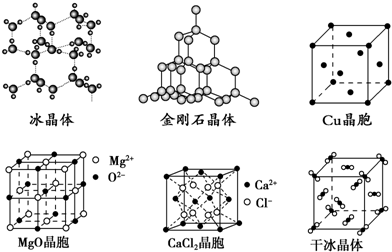
查看答案和解析>>
科目: 来源: 题型:解答题
 原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素之一,Y的基态原子最外层电子数是其内层电子总数的2倍,Z的基态原子2p轨道上有3个未成对电子,W的原子序数为29.
原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素之一,Y的基态原子最外层电子数是其内层电子总数的2倍,Z的基态原子2p轨道上有3个未成对电子,W的原子序数为29.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com