
科目: 来源: 题型:解答题
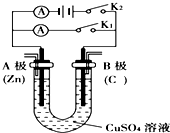 请按要求回答下列问题.
请按要求回答下列问题.查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.653 | 42.875 |
| A | B | C | D | |
| n(Fe2O3) | 0.350 | 0.027 | 0.080 | 0.080 |
| n(CO) | 0.010 | 0.010 | 0.010 | 0.050 |
| n(Fe) | 0.100 | 0.064 | 0.080 | 0.080 |
| n(CO2) | 0.035 | 0.088 | 0.040 | 0.050 |

查看答案和解析>>
科目: 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
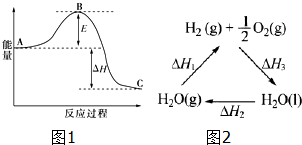
查看答案和解析>>
科目: 来源: 题型:多选题
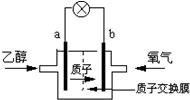
| A. | a极为电池的负极,乙醇被还原 | |
| B. | 电池工作时电子由b极沿导线经灯泡再到a极 | |
| C. | 电池正极的电极反应为:2H++O2+4e-=H2O | |
| D. | 电池工作时1mol乙醇被氧化时,就有12mol质子通过质子交换膜 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol/L | B. | 2mol/L | C. | 2.5mol/L | D. | 3mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 把铁块换成铁粉 | |
| B. | 将容器的体积压缩至原体积的一半 | |
| C. | 若保持压强不变,充入氮气使容器的体积增大 | |
| D. | 若保持体积不变,充入氮气使容器内的压强增大 |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:填空题
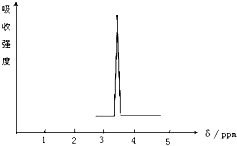 (1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:CH2BrCH2Br,请预测B的核磁共振氢谱上有2个峰(信号).
(1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:CH2BrCH2Br,请预测B的核磁共振氢谱上有2个峰(信号). 乙苯
乙苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com