
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaHCO3溶液(Na2CO3),应通入过量的CO2气体 | |
| B. | NaBr溶液(NaI),应加入适量的氯水、CCl4,进行萃取分液 | |
| C. | NH4Cl溶液(FeCl3),应加入适量的氨水,过滤 | |
| D. | CO2(CO),通过过量的灼热的氧化铜粉末 |
查看答案和解析>>
科目: 来源: 题型:解答题
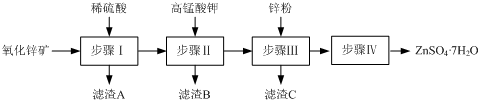
查看答案和解析>>
科目: 来源: 题型:填空题
| 浓度 反应条件 时间(s) | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360℃ | 480℃ | t℃ | 720℃ |
| MnO2催化剂、加热 | 10s | 25s | 60s | 120s |
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所 需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目: 来源: 题型:填空题
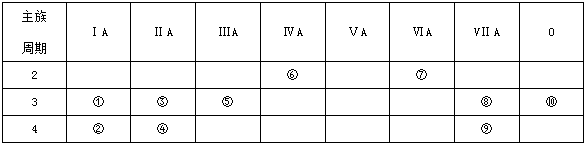
 ,用电子式表示⑦号元素氢化物的形成过程是
,用电子式表示⑦号元素氢化物的形成过程是 ,⑦号元素氢化物和元素②反应的离子方程式:2K+2H2O=2K++2OH-+H2↑.
,⑦号元素氢化物和元素②反应的离子方程式:2K+2H2O=2K++2OH-+H2↑.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X的分解速率与Y的消耗速率相等 | |
| B. | X、Y与Z的物质的量之比为2:1:1 | |
| C. | 混合气体的密度不再变化 | |
| D. | 单位时间内生成lmolY的同时分解1mol X |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | V(O2)=0.01mol/L•s | B. | V(NO)=0.008mol/L•s | ||
| C. | V(H2O)=0.003mol/L•min | D. | V(NH3)=0.002mol/L•s |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com