
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 蔗糖、淀粉、纤维素等有甜味 | 人体内,糖类在淀粉酶的作用下能发生水解,生成葡萄糖 |
| B | 煤通过气化和液化等化学变化可以有效地控制酸雨 | 煤通过气化和液化处理,其产品中硫的含量将大大降低 |
| C | 地沟油经过处理加工后可用作飞机、汽车燃油 | 地沟油的成分是液态烃 |
| D | 在钢铁制品的表面镀上一层锡,可有效防止其被腐蚀 | 形成原电池时锡是负极被氧化,而钢铁制品作为正极被保护 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
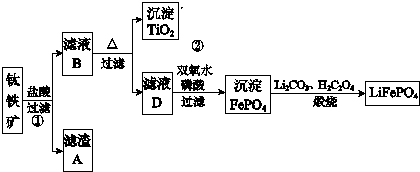
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
 ,写出各步反应的化学方程式.
,写出各步反应的化学方程式.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用 NaHCO3 溶液可一次鉴别出稀盐酸、NaOH溶液、AlCl3溶液、NaAlO2 溶液 | |
| B. | 高锰酸钾试剂瓶内壁上黑色物质可用稀盐酸洗涤 | |
| C. | 除去SO2 中少量HCl,将其通入饱和的Na2SO3 溶液 | |
| D. | 将硝酸铵晶体溶于水,测得水温下降,证明硝酸铵水解是吸热的 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com