
科目: 来源: 题型:解答题
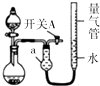 某同学设计图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| ① | Cu、浓HNO3 | H2O | |
| ② | CaO固体、浓氨水 | NH3 | |
| ③ | 粗镁、稀H2SO4 (足量)[杂质不与硫酸反应] | H2 | H2O |
| 编号 | 镁(含杂质)质量 | 量气管第一次读数 | 量气管第二次读数 |
| 1 | 0.5g | 10.0mL | 346.5mL |
| 2 | 0.5g | 10.0mL | 335.0mL |
| 3 | 0.5g | 10.0mL | 345.5mL |
查看答案和解析>>
科目: 来源: 题型:选择题
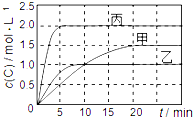 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 1L | 1L | 2L |
| 温度 | T1 | T2 | T2 |
| 反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
| A. | 由图可知:T1<T2,且该反应为吸热反应 | |
| B. | T1时该反应的平衡常数K=7.2 | |
| C. | 前10min甲、乙、丙三个容器中A的反应速率:v(A)甲<v(A)乙<v(A)丙 | |
| D. | 平衡时A的质量m:m乙<m甲<m丙 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙烯使溴水或酸性高锰酸钾褪色均属于加成反应 | |
| B. | 用乙醇与浓硫酸加热至170℃制乙烯的反应属于取代反应 | |
| C. | 用“地沟油”生产生物柴油只发生酯化反应 | |
| D. | 用重铬酸钾溶液检验司机是否酒驾所发生的反应属于乙醇的氧化反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 简单阳离子的氧化性:Y>X | |
| B. | 简单离子半径由大到小的顺序是:Z>M>Y | |
| C. | 气态氢化物的稳定性:Z<M | |
| D. | 等浓度的X2Z与Y2Z的溶液中,水的电离程度:X2Z<Y2Z |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 汽车尾气中发生的催化转化反应:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2 | |
| B. | 工业制氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O | |
| C. | 燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2 | |
| D. | 用Na2CO3溶液处理水垢中的不溶物CaSO4:CaSO4+CO32-═CaCO3+SO42- |
查看答案和解析>>
科目: 来源: 题型:填空题
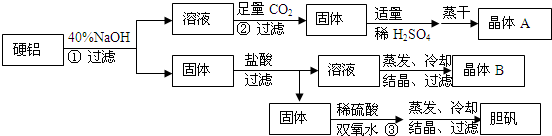
查看答案和解析>>
科目: 来源: 题型:填空题
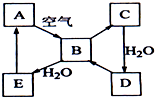 如图表示淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com