
科目: 来源: 题型:选择题
| A. | Na在足量O2中燃烧,消耗1mol O2时转移的电子数是4×6.02×1023 | |
| B. | 标准状况下,6.72L NO2与水分子充分反应转移的电子数目为0.1NA | |
| C. | 盐酸和醋酸的混合溶液pH=1,该溶液中c(H+)=0.1 mol/L | |
| D. | 1 L 0.1 mol/L NH4Cl溶液中的NH4+数是0.1×6.02×1023 |
查看答案和解析>>
科目: 来源: 题型:解答题
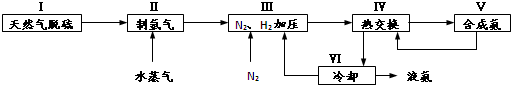
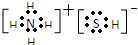 ,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.
,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.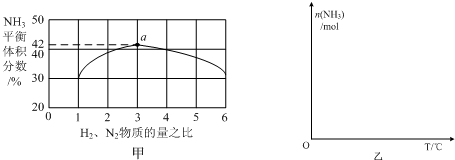
查看答案和解析>>
科目: 来源: 题型:选择题
 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如右图所示.则下列判断正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如右图所示.则下列判断正确的是( )| A. | 反应后溶液的酸性明显增强 | |
| B. | 消耗1 mol还原剂,转移6 mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 该反应的还原剂是Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Ca(ClO)2溶液中通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | |
| B. | 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入装有足量氯化钡溶液的洗气瓶中(如图装置),洗气瓶中产生的沉淀是硫酸钡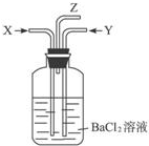 | |
| C. | 向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2 | |
| D. | 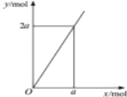 锌与不同浓度的硝酸可发生不同的反应(如图:y表示耗去Zn的物质的量,x表示被还原的硝酸的物质的量),4Zn+10HNO3(极稀)=4Zn(NO3)2+5H2O+N2O↑符合图示 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | AlN可通过反应Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO合成.该反应中,每生成1 mol AlN需转移1.5 mol电子 | |
| B. | CsICl2是一种碱金属的多卤化物,这类物质在化学反应中既可表现氧化性又可表现还原性,则在CsICl2溶液中通入Cl2,有单质碘生成 | |
| C. | 反应A+3B═2C+2D在四种不同情况下的反应速率分别为①v(A)=0.15 mol/(L•s);②v(B)=0.6 mol/(L•s);③v(C)=0.4 mol/(L•s);④v(D)=0.45 mol/(L•s).该反应进行的快慢顺序为④>③=②>① | |
| D. | AlCl3溶液中加入过量稀氨水,则反应的离子方程式为:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧化性(酸性溶液):FeCl3>Co(OH)3>I2 | B. | 还原性(碱性溶液):Fe(OH)2>I2>KIO3 | ||
| C. | 热稳定性:NaCl>NaClO>NaClO4 | D. | 酸性(水溶液):H2CO3>HSCN>HCN |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 液态钠可用作核反应堆的传热介质 | |
| B. | 在过渡元素中找寻半导体材料 | |
| C. | 考古时利用l4C测定一些文物的年代 | |
| D. | SiO2是光导纤维的成分 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属钠在空气中燃烧的火焰呈黄色,是因为生成的Na2O2为淡黄色固体 | |
| B. | 铁丝在Cl2中燃烧有红棕色的烟,是因为生成的FeCl3为红棕色固体 | |
| C. | 过量的铁加入稀HNO3,充分反应后,滴入KSCN溶液,溶液呈红色,说明稀HNO3将Fe氧化为Fe3+ | |
| D. | 取少量溶液X,向其中加入适量新制的氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
查看答案和解析>>
科目: 来源: 题型:填空题
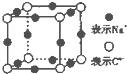 A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A~F为短周期主族元素,G为第四周期元素.已知:A是原子半径最小的元素,B和D同周期,固态的BD2能升华,E、F在B、D的下一周期,且E原子的最外层电子数与次外层电子数之比为3:4;G的质子数比F多12.请回答:
A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A~F为短周期主族元素,G为第四周期元素.已知:A是原子半径最小的元素,B和D同周期,固态的BD2能升华,E、F在B、D的下一周期,且E原子的最外层电子数与次外层电子数之比为3:4;G的质子数比F多12.请回答:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2O、Na2O2组成元素相同,均与H2O反应,均属于碱性氧化物 | |
| B. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈无色 | |
| C. | NO、SO2、NO2都是大气污染气体,在空气中都不能稳定存在 | |
| D. | SiO2是酸性氧化物,能与NaOH溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com