
科目: 来源: 题型:选择题
| A. | 只有①和② | B. | 只有②③④ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目: 来源: 题型:填空题
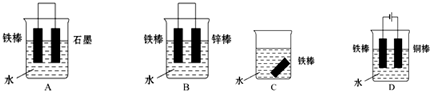
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题

| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀时的pH | 9.0 | 3.2 | 5.6 |
查看答案和解析>>
科目: 来源: 题型:选择题
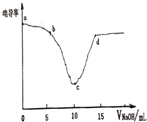 电导率可用于衡量电解质溶液的导电能力,即电导率越大,则溶液的导电能力越强.利用电导率传感器测得用0.100mol/L的NaOH溶液滴定10.00mL0.100mol/L的盐酸,电导率曲线如图所示.下列说法不正确的是( )
电导率可用于衡量电解质溶液的导电能力,即电导率越大,则溶液的导电能力越强.利用电导率传感器测得用0.100mol/L的NaOH溶液滴定10.00mL0.100mol/L的盐酸,电导率曲线如图所示.下列说法不正确的是( )| A. | d点溶液中:c(Cl-)=2c(OH-)-2c(H+) | |
| B. | 电导率传感器能用于酸碱中和滴定终点的判断 | |
| C. | c点电导率最小是因为c点溶液的溶质为弱电解质 | |
| D. | c(Na+)、c(Cl-)对导电能力的影响比c(H+)、c(OH-)对导电能力的影响小 |
查看答案和解析>>
科目: 来源: 题型:解答题
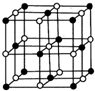
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢氧化钠溶液和稀盐酸反应:H++OH-═H2O | |
| B. | 大理石与盐酸反应制取二氧化碳:CO32-+2H+═H2O+CO2↑ | |
| C. | 铁粉投入FeCl3溶液中:Fe+Fe3+═2Fe2+ | |
| D. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3CH2CH(CH3)CH(CH3)OH 3-甲基-4-戊醇 | |
| B. |  3-甲基丁烯 3-甲基丁烯 | |
| C. |  2-甲基丁烷 2-甲基丁烷 | |
| D. | CH2Cl-CH2Cl 二氯乙烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com