
科目: 来源: 题型:填空题
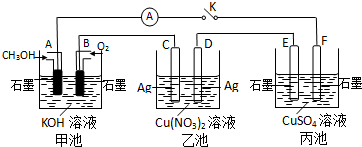
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cl-、Br-、CrO42- | B. | CrO42-、Br-、Cl- | C. | Br-、Cl-、CrO42- | D. | Br-、CrO42-、Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
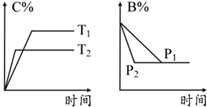
| A. | T1>T2 | B. | 正反应为放热反应 | ||
| C. | P1>P2 | D. | a+b=c+d |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | A.NH3(g)+$\frac{5}{4}$O2(g)═NO(g)+$\frac{6}{4}$H2O(g);△H=-akJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-bkJ•mol-1 | |
| C. | 2CO(g)+O2(g)═2CO2(g);△H=-ckJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)═CH3CHO(l)+H2O(l);△H=-dkJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 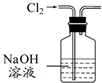 装置除去Cl2中含有的少量HCl | |
| B. | 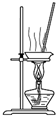 装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| C. | 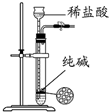 装置制取少量纯净的CO2气体 | |
| D. | 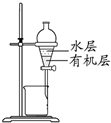 装置分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 编号 | 电极材料 | 电解质溶液 | 电流计指针 偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
查看答案和解析>>
科目: 来源: 题型:解答题
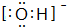 .
.查看答案和解析>>
科目: 来源: 题型:填空题
 (1)理论上讲,任何自发的氧化还原反应都可以设计成原电池.请利用反应“Cu+2Ag+=2Ag+Cu2+”设制一个化学电池(正极材料用碳棒),回答下列问题:
(1)理论上讲,任何自发的氧化还原反应都可以设计成原电池.请利用反应“Cu+2Ag+=2Ag+Cu2+”设制一个化学电池(正极材料用碳棒),回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
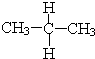 与
与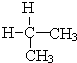 ⑦CH3CH3与
⑦CH3CH3与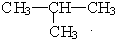
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com