
科目: 来源: 题型:选择题
| A. | AgI、AgCl与水混合后形成的分散系中:c(Ag+)=c(I-)>c(C1-) | |
| B. | 25℃时,在pH相等的NH4C1溶液和盐酸中,水的电离程度也相等 | |
| C. | 25℃时,将pH=11的NaOH溶液与pH=3的某弱酸HA的溶液等体积混合,混合后的溶液呈碱性 | |
| D. | 25℃时,在pH=2的H2C2O4 (一种二元弱酸)溶液与pH=12的NaOH溶液以任意比例混合后形成的溶液中,一定存在:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在0.1 mol•L-1NaOH溶液中:K+、Na+、SO42-、HCO3- | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:A13+、Na+、NO3-、C1- | |
| C. | 在0.1 mol•L-1FeCl3溶液中:K+、NH4+、I-、SCN- | |
| D. | 在$\frac{{c(H}^{+})}{{c(OH}^{-})}$=10-12的溶液中:K+、Na+、ClO-、NO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
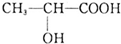 ,下列有关乳酸的说法中,不正确的是( )
,下列有关乳酸的说法中,不正确的是( )| A. | 乳酸中能发生酯化反应的官能团有2种 | |
| B. | 1 mol乳酸可与2 mol NaOH发生中和反应 | |
| C. | 1 mol乳酸与足量金属Na反应生成1 mol H2 | |
| D. | 有机物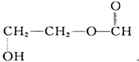 与乳酸互为同分异构体 与乳酸互为同分异构体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径大小的比较:r(X)>r(Y)>r(Z) | |
| B. | 元素Y、Z的简单离子的电子层结构不同 | |
| C. | 元素X的简单气态氢化物的热稳定性比元素Y的强 | |
| D. | 只含W、X、Y三种元素的化合物中,有离子化合物,也有共价化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁表面镀锌可增强其抗腐蚀性 | |
| B. | 人造纤维、合成纤维和光导纤维都是新型无机非金属材料 | |
| C. | 氢氧化铝可用于制作治疗胃酸过多的药物 | |
| D. | “煤改气”、“煤改电”等改造工程有利于减少雾霾天气 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
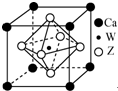 原子序数小于36的X、Y、Z、W四种元素,X基态原子的最外层电子数是其内层电子数的2倍,Y基态原子的2p原子轨道上有3个未成对电子,Z是地壳中含量最多的元素,W的原子序数为22.
原子序数小于36的X、Y、Z、W四种元素,X基态原子的最外层电子数是其内层电子数的2倍,Y基态原子的2p原子轨道上有3个未成对电子,Z是地壳中含量最多的元素,W的原子序数为22.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
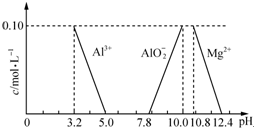 达喜[AlaMgb(OH)c(CO3)d•xH2O]常用于中和胃酸.
达喜[AlaMgb(OH)c(CO3)d•xH2O]常用于中和胃酸.查看答案和解析>>
科目: 来源: 题型:解答题
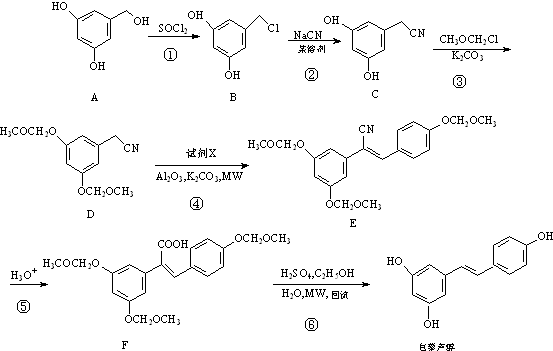
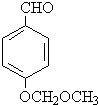 .
.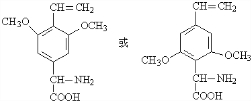 (任写一种).
(任写一种).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com