
科目: 来源: 题型:选择题
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78 g苯含有C=C键的数目为3 NA | |
| C. | 分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA | |
| D. | 1 mol FeI2与足量氯气反应时转移的电子数为2 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | “冰,水为之,而寒于水”说明相同质量的液态水和冰,液态水的能量高 | |
| B. | 雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒直径不相同 | |
| C. | 液态氟化氢中存在氢键,所以其分子比氯化氢稳定 | |
| D. | 用福尔马林灭掉活埃博拉病毒是利用了蛋白质变性原理 |
查看答案和解析>>
科目: 来源: 题型:解答题
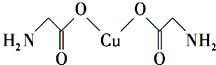 (1)钠镁铝三种元素中第一电离能最大的是Mg.
(1)钠镁铝三种元素中第一电离能最大的是Mg.| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1[ | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4°C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
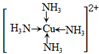 (标出配位键);
(标出配位键);查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n( N2) | 0 | 0.20 | 0.35 | 0.40 | 0.40 |
| T2 | n( N2) | 0 | 0.25 | … | 0.30 | 0.30 |
| A. | 10min内,T1时的v(N2)比T2时的小 | |
| B. | T1<T2 | |
| C. | a<0 | |
| D. | T2时,若向平衡后的容器中再充入1.2molCH4,重新达到平衡时n(N2)=0.40mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 每消耗1molCH4可以向外电路转移4mol电子 | |
| B. | 负极上CH4失去电子,电极反应式为CH4+10OH--8e-═CO32-+7H2O | |
| C. | 负极上是O2获得电子,电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 电池放电后,溶液pH不断升高 |
查看答案和解析>>
科目: 来源: 题型:选择题
 已知甲、乙、丙、丁是中学化学常见的物质,一定条件下可发生如图转化:下列相关离子方程式或化学方程式错误的是( )
已知甲、乙、丙、丁是中学化学常见的物质,一定条件下可发生如图转化:下列相关离子方程式或化学方程式错误的是( )| A. | ①可能为CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | B. | ①可能为Fe+2Fe3+═3Fe2+ | ||
| C. | ②可能为2NO+O2═2NO2 | D. | ②可能为CO32-+H2O+CO2═2HCO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 食品保鲜膜、一次性食品袋的主要成分是聚乙烯 | |
| B. | 在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量 | |
| C. | 若使用氯气处理水,能达到消毒杀菌和除去悬浮杂质的目的 | |
| D. | 一定浓度的双氧水可用于伤口的消毒 |
查看答案和解析>>
科目: 来源: 题型:解答题
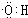 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.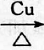 2CH3CHO+2H2O.
2CH3CHO+2H2O.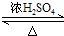 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.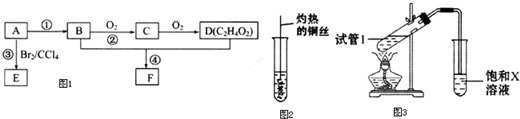
查看答案和解析>>
科目: 来源: 题型:选择题
 如图装置中,容器甲内充入0.1mol NO气体.干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加了2.24g.随着CO2的继续通入,活塞又逐渐向右移动.下列说法中正确的是( )
如图装置中,容器甲内充入0.1mol NO气体.干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加了2.24g.随着CO2的继续通入,活塞又逐渐向右移动.下列说法中正确的是( )| A. | 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L (标准状况) | |
| B. | NO2转化为N2O4的转化率为20% | |
| C. | 容器甲中NO已反应完 | |
| D. | 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com