
科目: 来源: 题型:选择题
| A. | 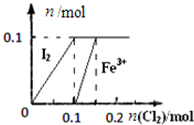 表示向100mL1 mol•L-1 FeI2溶液中逐渐通入Cl2,I2和Fe3+物质的量变化关系 | |
| B. | 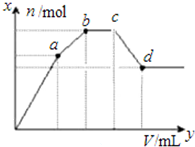 表示向100mL 0.1 mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol•L-1 Ba(OH)2溶液,沉淀物质的量变化的关系 | |
| C. |  表示在不同温度下,水溶液中c(H+)与c(OH-)变化关系 | |
| D. |  得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 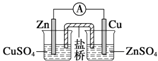 装置:构成锌-铜原电池 | |
| B. | 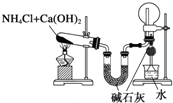 装置:实验室制氨气并收集干燥的氨气 | |
| C. | 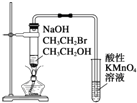 装置:验证溴乙烷发生消去反应生成烯烃 | |
| D. | 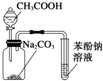 装置:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH |
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素 | U | V | W | X |
| 原子半径(nm) | 0.077 | 0.075 | 0.102 | 0.099 |
| 最高正价或最低负价 | +4 | +5 | -2 | -1 |
| A. | V的氢化物与X的氢化物反应的产物只含有共价键 | |
| B. | 1molX的单质参加氧化还原反应时转移的电子数为1.204×1024 | |
| C. | U与W形成UW2时各原子均满足8电子稳定结构 | |
| D. | 0.3molCu分别与足量HVO3和H2WO4的稀溶液反应均产生0.2mol气体 |
查看答案和解析>>
科目: 来源: 题型:解答题
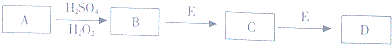
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酸性KI淀粉溶液在空气中久置后变蓝:4I-+O2+2H2O=2I2+4OH- | |
| B. | 用Na2CO3溶液处理水垢中的CaSO4:CO32-+CaSO4?CaCO3+SO42- | |
| C. | 铅蓄电池充电时阴极质量减轻:PbSO4+2e-=Pb+SO42- | |
| D. | 明矾与足量Ba(OH)2溶液混合有沉淀出现:Al3++2SO42-+4OH-+2Ba2+=2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验操作及现象 | 现象的解释 | |
| A | 将一片铝箔置于酒精灯外焰上灼烧,铝箔熔化但不滴落 | 单质铝的熔点特别高 |
| B | 用玻璃尖嘴导管导出氢气,点燃,观察到火焰呈黄色 | 普通玻璃中含有钠元素 |
| C | 往水中加入Na2O2固体,滴入酚酞呈红色,振荡,红色褪去 | 产生了碱性物质,且Na2O2具有漂白性 |
| D | 向过量的苯酚浓溶液中滴加少许饱和溴水,振荡,未观察到白色沉淀产生 | 三溴苯酚溶解在过量的苯酚中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在船外壳镶嵌锌块保护船身,锌为原电池的负极 | |
| B. | MgO的熔点高于NaCl,是因为MgO的晶格能大于NaCl | |
| C. | 1molFeCl3完全水解将产生6.02×1023个胶体粒子 | |
| D. | 水的离子积常数Ksp随着温度的升高而增大,说明水的电离是吸热过程 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硅胶和铁粉常用于食品包装袋中作抗氧化剂,它们都是无机物 | |
| B. | 食盐和食醋常用于厨房中作调味品,它们都是盐 | |
| C. | 硅和石英常用于制作光导纤维,它们都是原子晶体 | |
| D. | 氢氧化铝和碳酸氢钠常用于消除胃酸过多,它们都是电解质 |
查看答案和解析>>
科目: 来源: 题型:解答题

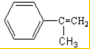
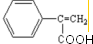
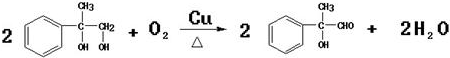 ;反应⑦n
;反应⑦n $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$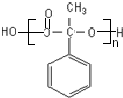 +(n-1)H2O
+(n-1)H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com