
科目: 来源: 题型:选择题
| A. | 原子序数X>Y | B. | 原子半径X<Y | ||
| C. | X和Y一定同周期 | D. | X是第ⅡA族元素,Y是第VⅡA族元素 |
查看答案和解析>>
科目: 来源: 题型:选择题
 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池,电子移动方向如图中所标.下列叙述错误的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池,电子移动方向如图中所标.下列叙述错误的是( )| A. | a为正极是金属铜,b为负极是金属锌 | |
| B. | a极上H+得到电子,发生氧化反应 | |
| C. | b极金属发生反应(或称被腐蚀),发生氧化反应 | |
| D. | 该装置将化学能转变为电能 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某种核素的相对原子质量 | |
| B. | 某种核素的质量数 | |
| C. | 某种元素所有核素质量数的平均值 | |
| D. | 某种元素的平均相对原子质量的近似值 |
查看答案和解析>>
科目: 来源: 题型:解答题
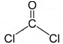 ,分子的立体构型是平面三角形.
,分子的立体构型是平面三角形.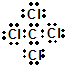 ,与CCl4互为等电子体的分子和离子分别有SiCl4和SO42-(各举一例,写化学式).
,与CCl4互为等电子体的分子和离子分别有SiCl4和SO42-(各举一例,写化学式).查看答案和解析>>
科目: 来源: 题型:多选题
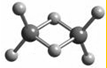 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n,常用作还原剂 .已知最简单的氢铝化合物的化学式为Al2H6,它的熔点为150℃且熔融状态不能导电,燃烧时放出大量的热量.Al2H6的球棍模型如图所示.下列说法错误的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n,常用作还原剂 .已知最简单的氢铝化合物的化学式为Al2H6,它的熔点为150℃且熔融状态不能导电,燃烧时放出大量的热量.Al2H6的球棍模型如图所示.下列说法错误的是( )| A. | Al2H6中Al为-3价,H为+1价 | |
| B. | Al2H6中含有离子键和极性共价键 | |
| C. | Al2H6在固态时所形成的晶体是分子晶体 | |
| D. | Al2H6在空气中完全燃烧,产物为氧化铝和水 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | N2比P4的化学性质稳定 | |
| B. | F2、C12、Br2、I2的沸点逐渐升高 | |
| C. | 金刚石的熔点比晶体硅高 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com