
科目: 来源: 题型:选择题
| A. | ②③④ | B. | ②③⑧ | C. | ③④⑤⑦⑧ | D. | ②⑥⑦⑧ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 有机化合物都是从有机体中提炼出来的 | |
| B. | 有机物和无机物的性质完全不同 | |
| C. | 所有有机物均含有碳元素 | |
| D. | 所有有机物均含有氢元素 |
查看答案和解析>>
科目: 来源: 题型:填空题
 、
、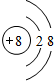 、
、 、
、 、
、 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| A | ||
| B | C | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe2(SO4)3和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| B. | 等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+$\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O | |
| D. | 0.01 mol•L-1 NH4Al(SO4)2溶液与0.02 mol•L-1 Ba(OH)2溶液等体积混合:NH4++Al3++2 SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 质子数相等、电子数和原子数不相等:① | |
| B. | 质子数和电子数相等、原子数不相等:② | |
| C. | 电子数相等、质子数和原子数不相等:③ | |
| D. | 原子数和电子数相等、质子数不相等:④ |
查看答案和解析>>
科目: 来源: 题型:解答题
| A-B | A=B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| N2 | 154.8 | 418.4 | 941.7 |
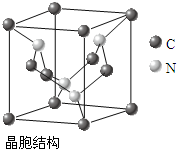
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com