
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用湿润的红色石蕊试纸检验氨气 | |
| B. | 过量的铜与浓硝酸反应有一氧化氮生成 | |
| C. | 金属钠着火时,可用二氧化碳灭火器灭火 | |
| D. | Na2CO3的热稳定性大于NaHCO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Q2<$\frac{{Q}_{1}}{2}$ | B. | Q2>$\frac{{Q}_{1}}{2}$ | C. | Q2=$\frac{{Q}_{1}}{2}$ | D. | 不能确定 |
查看答案和解析>>
科目: 来源: 题型:选择题
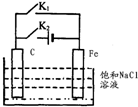
| A. | 断开 K2,闭合 K1时,Fe 电极反应为:2 H++2e-=H2↑ | |
| B. | 断开 K2,闭合 Kl 时,C电极反应为:2Cl--2e-=Cl2↑ | |
| C. | 断开 K1,闭合 K2时,Fe 电极反应为:Fe-2e-=Fe2+ | |
| D. | 断开 Kl,闭合 K2时,C电极反应为:2Cl--2e-=Cl2↑ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向Fe2(SO4)3溶液中加入过量的Na2S:2Fe3++S2-=2Fe2++S↓ | |
| B. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 用铜作电极电解饱和食盐水:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 将铜屑加入Fe3+ 溶液中:2Fe3++Cu=2Fe2++Cu2+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1160 | B. | 2308 | C. | 1441 | D. | 2320 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钠的金属活泼性大于铜,在溶液中钠可以置换出铜 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解,再加入KNO3固体,铜粉仍不溶解 | |
| C. | 在KI溶液中加入NaNO3,没有明显现象,加入盐酸,即有I2生成 | |
| D. | 纯锌与稀硫酸反应产生氢气的速率较,加入少量CuSO4固体,速率不改变 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
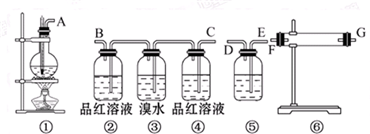
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com