
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

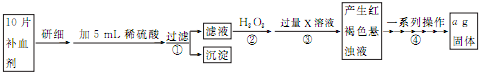

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 通入CO2,溶液pH减小 | |
| B. | 加入少量NH4Cl固体,平衡向正反应方向移动 | |
| C. | 慢慢升高温度,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$逐渐增大 | |
| D. | 加入NaOH 固体,溶液的KW=c(OH-)•c(H+)增大 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 该电池放电时,图中电极a是正极,c是负极 | |
| B. | 该电池放电时,水性电解质pH不变 | |
| C. | 当给该锂-空气电池充电时,c极应接电源的负极 | |
| D. | 当给该锂-空气电池充电时,b极的电极反应式为4OH--4e-=2H2O+O2↑ |
查看答案和解析>>
科目: 来源: 题型:填空题


 .
. .
. .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
| X的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
| Y元素的族序数是周期序数的三倍 |
| Z元素的电负性在所有元素中最大 |
| W原子的第一至第六电离能分别为:I1=578KJ•mol-1,I2=1817KJ•mol-1,I3=2745KJ•mol-1,I4=11575KJ•mol-1,I5=14830KJ•mol-1,I6=18376KJ•mol-1 |
| Q为前四周期中电负性最小的元素 |
| R原子最高能层上只有1个单电子,其余各能层均已充满电子. |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 质量相等,密度不等的N2和C2H4两种气体含有的分子数一定相等 | |
| B. | 同温同压下,等体积的H2和He气含有的质子数相等 | |
| C. | 某物质经分析仅含一种元素,此物质可能是纯净物也可能是混合物 | |
| D. | FeCl3溶液呈电中性,Fe(OH)3胶体带有电荷 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将河水经过沉淀、过滤、活性炭吸附等净化处理后,所得的水就是纯水 | |
| B. | 水是一种常见的溶液 | |
| C. | 煮沸可以降低自来水的硬度 | |
| D. | 电解水实验说明水是由氢气和氧气组成的 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Al | B. | Mg | ||
| C. | Na | D. | 三者产生的氢气一样多 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com