
科目: 来源: 题型:填空题
 (1)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层.
(1)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层.
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
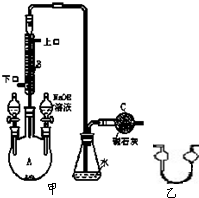 制备溴苯的实验装置如图所示,回答下列问题:
制备溴苯的实验装置如图所示,回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
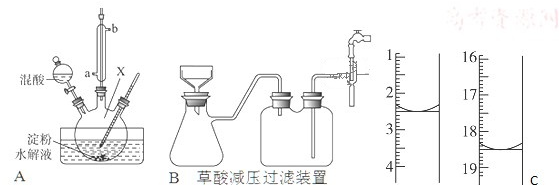
查看答案和解析>>
科目: 来源: 题型:解答题
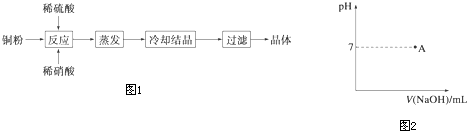
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向Na2CO3饱和溶液中,通入过量的CO2后,在减压、加热的条件下,蒸发得NaHCO3晶体 | |
| B. | 加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体 | |
| C. | 向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体 | |
| D. | 向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3 |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
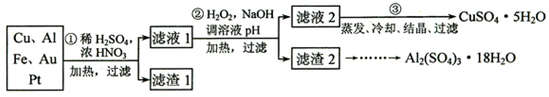
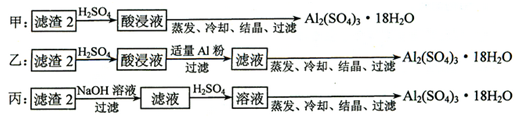
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 只有①④ | B. | 只有②③④⑤ | C. | 只有①②③④ | D. | 全部 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SO2、CaO、CO均为酸性氧化物 | |
| B. | 硫酸钡和水都是弱电解质 | |
| C. | 向煮沸的1mol•L-1 NaOH溶液中滴加饱和FeCl3溶液制备Fe(OH)3胶体 | |
| D. | 福尔马林、水玻璃、氨水均为混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com