
科目: 来源: 题型:阅读理解
 CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95ⅹ1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95ⅹ1011| c(CH3CH2OH)×c3(H2O) |
| c2(CO2)×c6(H2) |
| c(CH3CH2OH)×c3(H2O) |
| c2(CO2)×c6(H2) |
| 温度(K) | 500 | 600 | 700 | 800 |
| CO2转化率(%) | 60 | 43 | 28 | 15 |
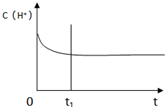
| n(H2) |
| n(CO2) |

查看答案和解析>>
科目: 来源: 题型:阅读理解
| D | ||||
| W | ||||
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 头孢呋辛酯胶囊是一种消炎药,其主要成分是头孢呋辛酯,适用于敏感细菌引起的上呼吸道感染,下呼吸道感染,泌尿道感染及皮肤和软组织感染等,它的结构式如图:
头孢呋辛酯胶囊是一种消炎药,其主要成分是头孢呋辛酯,适用于敏感细菌引起的上呼吸道感染,下呼吸道感染,泌尿道感染及皮肤和软组织感染等,它的结构式如图: ,关于头孢呋辛酯的下列说法不正确的是( )
,关于头孢呋辛酯的下列说法不正确的是( )查看答案和解析>>
科目: 来源: 题型:
 2C(g),若容器体积不变,下列措施可以增加C的产率的是( )
2C(g),若容器体积不变,下列措施可以增加C的产率的是( )查看答案和解析>>
科目: 来源: 题型:阅读理解
 (2013?渭南二模)决定物质性质的重要因素是物质结构.请回答下列问题.
(2013?渭南二模)决定物质性质的重要因素是物质结构.请回答下列问题.| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ?mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com