
科目: 来源: 题型:

| 用品(填序号) | 现象 | 结论 | 实验1 | ①③ | 溶液呈红色 | HCl没有漂白性 HCl没有漂白性 |
实验2 | ②⑤ ②⑤ |
试纸不褪色 试纸不褪色 |
Cl2没有漂白性 | 实验3 | ②④ ②④ |
试纸先变红后褪色 试纸先变红后褪色 |
Q具有漂白性 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
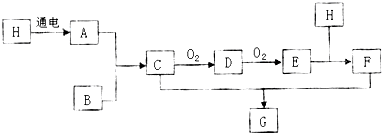
查看答案和解析>>
科目: 来源: 题型:
| 编号 | 物质 | 离子方程式 | ① | NaHCO3(Na2CO3) | CO32-+CO2+H2O=2HCO3- CO32-+CO2+H2O=2HCO3- |
② | SiO2(CaCO3) | CaCO3+2H+=Ca2++H2O+CO2↑ CaCO3+2H+=Ca2++H2O+CO2↑ |
③ | Fe2O3(Al2O3) | A12O3+2OH-=2Al3++H2O A12O3+2OH-=2Al3++H2O |
④ | FeCl2(FeCl3) | 2Fe3++Fe=3Fe2+ 2Fe3++Fe=3Fe2+ |
查看答案和解析>>
科目: 来源: 题型:
| ||
| △ |
| ||
| △ |


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com