
科目: 来源: 题型:解答题
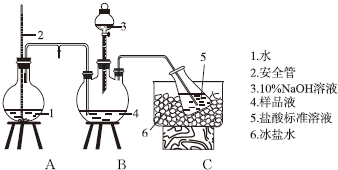
查看答案和解析>>
科目: 来源:2016-2017学年辽宁沈阳东北育才学校高一阶段考一化学卷(解析版) 题型:选择题
标准状况下某种O2和N2的混合气体mg含有b个分子,则ng该混合气体在相同状况下所占的体积应是( )
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目: 来源: 题型:解答题
 A、B、C、D、E、F为前四周期的元素.其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为红色固体,可通过“湿法冶金”而得.请回答下列问题:
A、B、C、D、E、F为前四周期的元素.其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为红色固体,可通过“湿法冶金”而得.请回答下列问题: .
.查看答案和解析>>
科目: 来源: 题型:解答题
 .(若有配位键,用箭号表示)
.(若有配位键,用箭号表示)
查看答案和解析>>
科目: 来源: 题型:解答题
| U | ||
| Y |
| 选 项 | a | b | C | d |
| X | 温度 | 温度 | 加入H2的 物质的量 | 加入甲的 物质的量 |
| V | 混合气体总质量与混合合气 体总物质的量之比 | 平衡常数 K | 混合气体的 密度 | 平衡时甲的 转化率 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ③⑤ | B. | ①③④ | C. | ②③④ | D. | ②③④⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cu2S在反应中既是氧化剂又是还原剂 | |
| B. | 以上反应中转移电子的物质的量为1 mol | |
| C. | 以上参加反应的HNO3中被还原的HNO3为2 mol | |
| D. | 反应中,氧化剂和还原剂的物质的量之比为4:3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 红棕色的NO2加压后颜色先变深后变浅(已知:2NO2 (g)?N2O4 (g)) | |
| B. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| C. | 对H2(g)+I2(g)?2HI(g),平衡体系增大压强可使颜色变深 | |
| D. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com