
科目: 来源: 题型:
 将一定质量的镁铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示.由图中数据计算:
将一定质量的镁铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示.由图中数据计算:查看答案和解析>>
科目: 来源: 题型:
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:

| ||
| ||
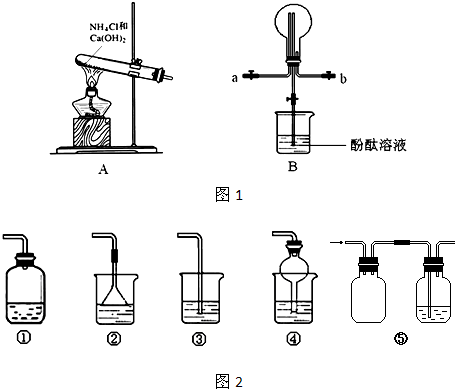
| B中棉花的位置 | ① | ② | ③ |
| 所蘸试剂 | 滴有酚酞的NaOH试液 | 品红溶液 | 淀粉和碘水混合液 |
| 现象 | 溶液红色消失 溶液红色消失 |
品红褪色 品红褪色 |
蓝色褪色 蓝色褪色 |
| 体现SO2的性质 | 酸性 酸性 |
漂白性 漂白性 |
还原性 还原性 |
查看答案和解析>>
科目: 来源: 题型:
 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图所示(部分反应中的水已略去).
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图所示(部分反应中的水已略去). Fe(OH)3+3H+
Fe(OH)3+3H+ Fe(OH)3+3H+
Fe(OH)3+3H+查看答案和解析>>
科目: 来源: 题型:
| ||
| ||
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
某同学用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(盐酸的物质的量浓度相等).下列分析推理不正确的是( )
|
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com