
科目: 来源: 题型:选择题
| A. | 50 mL 0.1 mol/L的NaCl溶液 | B. | 100 mL 0.2 mol/L的NaCl溶液 | ||
| C. | 25 mL 0.2 mol/L的Na2SO4溶液 | D. | 10 mL 0.5 mol/L的Na2CO3溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2S04溶液加人BaCl2固体 | B. | Ba(0H)2溶液中加人CuS04(少量)固体 | ||
| C. | Na0H溶液通人HCl | D. | H2O中加人NaCl固体 |
查看答案和解析>>
科目: 来源: 题型:解答题
 )是比较简单的稠环芳香烃.请回答以下问题:
)是比较简单的稠环芳香烃.请回答以下问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②④⑥ | B. | ①③⑤ | C. | ②③⑥ | D. | ②④⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol/L MgCl2溶液中含Cl-数为2NA | |
| B. | 标准状况下,2.24 L 18O2中所含中子的数目是2NA | |
| C. | 1 mol Al3+含有核外电子数为10NA | |
| D. | 常温常压下,16 g CH4中含有的原子总数为5NA |
查看答案和解析>>
科目: 来源: 题型:填空题



查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 摩尔是用来衡量微观粒子多少的一种物理量 | |
| B. | 在一定的温度和压强下,各种气体的摩尔体积相等 | |
| C. | 阿伏加德罗常数的数值是0.012kg14C所含的原子个数 | |
| D. | 若气体摩尔体积为22.4L•mol-1,则所处条件为标准状况 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA | |
| B. | 标准状况下,1.12L氦气所含原子数为0.1NA | |
| C. | 17gNH3所含电子数目为NA | |
| D. | 22.4LHCl溶于水,溶液中H+数为NA |
查看答案和解析>>
科目: 来源: 题型:选择题
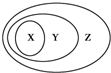 下表所列的一些物质或概念间的从属关系中,不符合图示要求的是( )
下表所列的一些物质或概念间的从属关系中,不符合图示要求的是( )| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 碱 | 电解质 | 化合物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 酸性氧化物 | 非金属氧化物 | 化合物 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com