
科目: 来源: 题型:选择题
| A. | 0.01mol•L-1的蔗糖溶液 | B. | 0.01mol•L-1的CaCl2溶液 | ||
| C. | 0.02mol•L-1的NaCl溶液 | D. | 0.02mol•L-1的CH3COOH溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |

查看答案和解析>>
科目: 来源: 题型:解答题
 铁是日常生活中广泛应用的金属.亚铁离子是血红蛋白的主要成分,它肩负着输送O2的重任.
铁是日常生活中广泛应用的金属.亚铁离子是血红蛋白的主要成分,它肩负着输送O2的重任. .一定温度下,将2mol的W气体置于密闭容器中,保持压强不变,温度由T1升高到T2的过程中,气体逐渐变为无色.若保持T2,增大压强,气体又逐渐变为红棕色.气体的物质的量n随温度T变化的关系如图所示.温度在T2~T3之间,气体的平均相对分子质量是(保留1位小数)30.7.
.一定温度下,将2mol的W气体置于密闭容器中,保持压强不变,温度由T1升高到T2的过程中,气体逐渐变为无色.若保持T2,增大压强,气体又逐渐变为红棕色.气体的物质的量n随温度T变化的关系如图所示.温度在T2~T3之间,气体的平均相对分子质量是(保留1位小数)30.7.查看答案和解析>>
科目: 来源: 题型:解答题
 二甲基亚砜有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下
二甲基亚砜有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下 生成甲硫醚(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜,
生成甲硫醚(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜,查看答案和解析>>
科目: 来源: 题型:解答题
 短周期元素A、B、C、D、E、F、G原子序数依次递增,已知A和D,C和G为同一主族元素,D形成的阳离子和C形成的阴离子具有相同的核外电子排布,B原子的最外层电子数比次外层多3,G形成的化合物甲是造成酸雨的主要原因,F和A可形成化合物FA4很不稳定,F与C形成的化合物是制造光导纤维的主要原料,E的最高价氧化物的水化物能溶解于D的最高价氧化物的水化物中.请回答下列问题:
短周期元素A、B、C、D、E、F、G原子序数依次递增,已知A和D,C和G为同一主族元素,D形成的阳离子和C形成的阴离子具有相同的核外电子排布,B原子的最外层电子数比次外层多3,G形成的化合物甲是造成酸雨的主要原因,F和A可形成化合物FA4很不稳定,F与C形成的化合物是制造光导纤维的主要原料,E的最高价氧化物的水化物能溶解于D的最高价氧化物的水化物中.请回答下列问题: .画出G离子的结构示意图
.画出G离子的结构示意图
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 汽油燃料电池的能量转化率比汽油在发动机中燃烧产生动力的能量转化率高 | |
| B. | 通入的空气为阳极,电极反应为O2+4e-═2O2- | |
| C. | 负极的电极反应为:C4H10-26e-+13O2-═4CO2+5H2O | |
| D. | 该电池可能出现气体通道被堵塞的问题 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 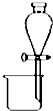 分离碘酒中的碘和酒精 | B. | 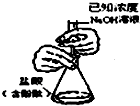 滴定法测定盐酸的浓度 | ||
| C. | 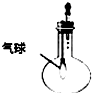 验证NH3的溶解性 | D. | 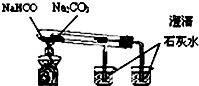 比较Na2CO2、NaHCO2的热稳定性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NO2能支持燃烧 | |
| B. | NO2不能支持燃烧 | |
| C. | 木条复燃是因为硝酸铜分解产生了氧气的缘故 | |
| D. | 不能判断NO2是否支持燃烧 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1molCl2与一定量的Fe刚好完全反应电子转移数为3NA | |
| B. | 标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g | |
| C. | 在 H2O2+Cl2═2HCl+O2反应中,每生成NA个O2分子,消耗的Cl2的体积是22.4L | |
| D. | 将10mL5mol•L-1的FeCl3溶液滴入沸水中得到Fe(OH)3胶体,其胶粒数为0.05NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com