
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 实验 编号 |
T/℃ | 大理石 规格 |
C(HNO3)/ mol?L-1 |
实验目的 | ① | 25 | 粗颗粒 | 2.00 | (Ⅰ) 实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验②和 ③ ③ 探究温度对该反应速率的影响;(Ⅲ)实验②和 ④ ④ 探究大理石规格(粗、细)对该反应速率的影响;) |
② | 1.00 | ③ | 35 | ④ | 细颗粒 |
查看答案和解析>>
科目: 来源: 题型:
 二氧化硫是常用的化工原料,工业上常用它来制取硫酸.反应之一是:
二氧化硫是常用的化工原料,工业上常用它来制取硫酸.反应之一是:查看答案和解析>>
科目: 来源: 题型:
 酸、碱、盐都是电解质,在水中都能电离出离子.根据下列化合物:
酸、碱、盐都是电解质,在水中都能电离出离子.根据下列化合物:查看答案和解析>>
科目: 来源: 题型:
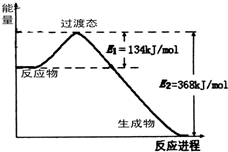 能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料. 查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com