
科目: 来源: 题型:选择题
| A. | 表示五氧化二磷分子是由磷元素与氧元素组成的 | |
| B. | 表示4个磷原子和10个氧原子 | |
| C. | 表示2个五氧化二磷分子,有4个磷原子和10个氧原子 | |
| D. | 表示2个五氧化二磷分子,每个五氧化二磷分子中含有2个磷原子和5个氧原子 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 工业上可通过电解熔融的AlCl3来得到金属铝 | |
| B. | 电解饱和食盐水制氯气可采用铁作为阳极 | |
| C. | 炒菜铁锅易生锈是因为形成了原电池,铁作负极 | |
| D. | 工业上一般采用铝热法冶炼金属镁 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 二氧化硅用途广泛,石英、水晶、光导纤维的主要成分都是二氧化硅 | |
| B. | 碘是人体必需微量元素,日常生活中食用的加碘盐中添加的是碘单质 | |
| C. | 漂白粉既可作棉、麻、纸张的漂白剂,又可作游泳池的消毒剂 | |
| D. | 燃煤时加入适量石灰石,可减少废气中SO2的量 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
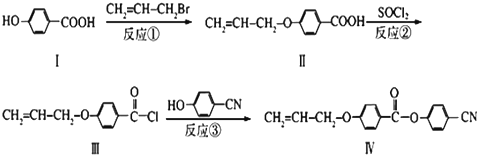

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,15g甲基(-14CH3)所含的电子数为9NA | |
| B. | 6.8g液态KHSO4中含有0.1NA个阳离子 | |
| C. | 常温下,2L pH=12的Na2CO3溶液中含有的OH-数目为0.02NA | |
| D. | 1mol乙酸和1mol乙醇充分反应生成的水分子数为NA |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质.他们采用了以下操作制备胶体,请将空白处填写完整.
某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质.他们采用了以下操作制备胶体,请将空白处填写完整.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com