
科目: 来源: 题型:选择题
| A. | 原子最外层电子数大于4的元素可能是金属元素 | |
| B. | 含有共价键的物质一定是共价化合物 | |
| C. | 离子化合物中只可能含有离子键而不可能含有共价键 | |
| D. | 多种非金属元素之间形成的共价键一定是极性键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在多电子的原子里,能量高的电子通常在离核近的区域内活动 | |
| B. | 核外电子只有排满了M层后才排N层 | |
| C. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| D. | 化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程 |
查看答案和解析>>
科目: 来源: 题型:填空题
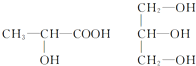 按要求完成下列问题.
按要求完成下列问题.查看答案和解析>>
科目: 来源: 题型:填空题
 生物质能是一种洁净,可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.
生物质能是一种洁净,可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 实 验 用 品 | 溶 液 温 度 | 中和热 △H | |||
| t1 | t2 | ||||
| ① | 50mL 0.55mol.L-1NaOH | 50mL 0.5mol.L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL 0.55mol.L-1NaOH | 50mL 0.5mol.L-1HCl | 20℃ | 23.5℃ | |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p1${\;}^{2{2}^{3}}$③1s22s22p2④1s22s22p63s23p4 原子半径最大的是① | |
| B. | 具有下列价电子排布式的原子中,①3s23p1 ②3s23p 2 ③3s23p3 ④33s23p 4第一电离能最大是③ | |
| C. | ①Na、K、Rb ②N、P、Si ③Na、P、Cl,元素的电负性随原子序数增大而递增的是③ | |
| D. | 某主族元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703…,当它与氯气反应时生成的阳离子是X3+ |
查看答案和解析>>
科目: 来源: 题型:解答题
 用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:?
用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:?查看答案和解析>>
科目: 来源: 题型:解答题

 ,该有机反应的类型为取代反应.
,该有机反应的类型为取代反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com