
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2A是弱酸 | |
| B. | 稀释0.1mol/L H2A溶液,因电离平衡向右移动而导致c(H+)增大 | |
| C. | 在0.1mol/L的H2A溶液中,c(H+)=0.12mol/L | |
| D. | 若0.1mol/L的NaHA溶液中c(H+)=0.02mol/L,则0.1mol/L的H2A溶液中c(H+)<0.12mol/L |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| C. | 1L0.1mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| D. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n净产生的中子(${\;}_{0}^{1}$n)数为10NA |
查看答案和解析>>
科目: 来源: 题型:解答题
 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol甲基所含有的电子数为10NA | |
| B. | 标准状况下,11.2L氯仿(CHCl3)中含有C-Cl键的数目为1.5NA | |
| C. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA | |
| D. | 6.0g冰醋酸与4.6g乙醇反应生成乙酸乙酯的分子数为0.1 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 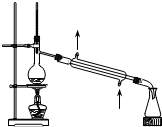 装置可用于分离苯和溴苯的混合物 | B. | 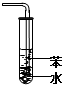 装置可用于吸收HCl或NH3气体 | ||
| C. | 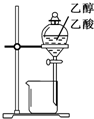 用图所示装置分离乙醇与乙酸 | D. | 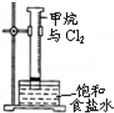 图中量筒中发生了加成反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
 加入0.2mol的MnO2粉末于100mL过氧化氢的溶液中(密度为1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:
加入0.2mol的MnO2粉末于100mL过氧化氢的溶液中(密度为1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题

 ,E的电子式
,E的电子式 ,y的结构式H-Cl;
,y的结构式H-Cl; ;反应②的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2反应⑤的离子方程式为2Fe3++Fe=3Fe2+
;反应②的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2反应⑤的离子方程式为2Fe3++Fe=3Fe2+查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com