
科目: 来源: 题型:解答题
 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氮肥NH4NO3在重力撞击下可能发生爆炸 | |
| B. | 在食品袋中放入盛有硅胶的透气小袋 | |
| C. | 二氧化硅可用于制备太阳能电池板 | |
| D. | 装饰材料释放的甲醛会造成污染 |
查看答案和解析>>
科目: 来源: 题型:解答题
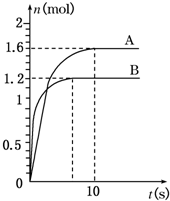
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液是呈电中性的,而胶体是可以带电的 | |
| B. | 向沸水中加入FeCl3饱和溶液,继续煮沸至溶液呈红褐色时即得到Fe(OH)3胶体 | |
| C. | 清晨,阳光透过树叶间的缝隙可以产生丁达尔效应,说明空气是一种胶体 | |
| D. | 常用于区分溶液和胶体的方法是利用丁达尔效应,属于化学方法 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若硫酸足量会有氢气生成 | |
| B. | 离子方程式为Cu2O+2H+=Cu2++Cu+H2O | |
| C. | 会得到蓝色溶液 | |
| D. | 氧化剂、还原剂均是Cu2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+ K+ SO42- HCO3- | B. | Cu2+ K+ SO42- NO3- | ||
| C. | Na+ K+Cl- NO3- | D. | Fe3+ K+ SO42- Cl- |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com