
科目: 来源: 题型:解答题
 高铁酸钾是一种新型非氯高效消毒剂,常用于工业废水与城市生活污水的处理.某小组同学为研究高铁酸钾对水溶液中苯酚的降解反应速率,在恒定实验温度298K或318K条件下(其余实验条件见下表),设计如下对比实验.
高铁酸钾是一种新型非氯高效消毒剂,常用于工业废水与城市生活污水的处理.某小组同学为研究高铁酸钾对水溶液中苯酚的降解反应速率,在恒定实验温度298K或318K条件下(其余实验条件见下表),设计如下对比实验.| 实验编号 | pH | 投料比(高铁酸钾与苯酚的质量比) | T/K | Fe3+ | 实验目的 |
| Ⅰ | 4 | 10:1 | 298 | 0 | 参照实验 |
| Ⅱ | 4 | 8:1 | 298 | 0 | |
| Ⅲ | 探究温度对该降解反应速率的影响 |
查看答案和解析>>
科目: 来源: 题型:解答题
 =2KMnO4$\stackrel{△}{→}$
=2KMnO4$\stackrel{△}{→}$ +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O +HCl→
+HCl→ +KCl
+KCl
| 序号 | 实验方案 | 试验现象 | 结论 |
| ① | 将白色固体B加入水中,加热 溶解,冷却过滤 | 得到白色晶体和无色滤液 | |
| ② | 取少量滤液于试管中, 滴入适量的硝酸酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,加热使其熔化, 测得熔点 | 测得熔点为122.4℃ | 白色晶体是苯甲酸 |
查看答案和解析>>
科目: 来源: 题型:解答题
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | A的平均反应速率为0.15mol/(L•min) | |
| B. | 平衡时,A的转化率为20% | |
| C. | 平衡时,C的浓度为0.25mol/L | |
| D. | 容器内的起始压强和平衡压强之比为11:10 |
查看答案和解析>>
科目: 来源: 题型:解答题
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目: 来源: 题型:解答题
 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应如下,
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应如下, $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ ,实验装置如图所示.可能用到的有关数据如表:
,实验装置如图所示.可能用到的有关数据如表:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目: 来源: 题型:填空题
 实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:相关数据如下:
实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:相关数据如下:| 相对分子质量 | 密度/(g•cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
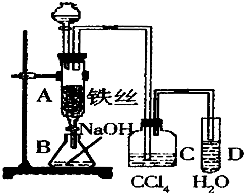 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.查看答案和解析>>
科目: 来源: 题型:填空题
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com