
科目: 来源: 题型:选择题
| A. | 碱性氧化物一定是金属氧化物 | |
| B. | Na2O、Na2O2组成元素相同,阳离子与阴离子个数比也相同 | |
| C. | Na2O2、HClO、SO2等物质都具有漂白作用 | |
| D. | 共价化合物固态时不导电,熔融态时导电 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 研究硫及其化合物性质有重要意义.
研究硫及其化合物性质有重要意义.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应过程中CO2过量,溶液的pH<7 | B. | 水的离子积常数Kw<10-14 | ||
| C. | 2c(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)] | D. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 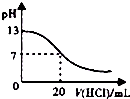 如图表示室温时,用0.1 mol.L-1 盐酸滴定0.1 mol•L-1NaOH溶液过程中的pH变化 | |
| B. | 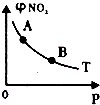 T℃时,反应2NO2(g)  N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图所示,则A点的颜色深,B点的颜色浅 N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图所示,则A点的颜色深,B点的颜色浅 | |
| C. | 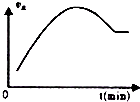 如图表示向绝热恒容密闭容器中通入A2和B2,一定条件下使反应2A2(g)+B2(g)?2C(g)达到平衡,正反应速率随时间变化的示意图.由图可得出的结论是:反应物的总能量低于生成物的总量 | |
| D. | 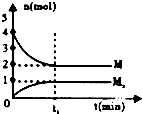 如图在恒温恒容的密闭容器中,气体M存在如下关系xM(g)?Mx(g),t1时刻,保持温度不变,再充入1mol M,重新达到平衡时$\frac{c(Mx)}{c(M)}$将增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由题给△H值可知,该反应是一个放热反应 | |
| B. | △S>0表明该反应是一个熵增加的反应 | |
| C. | 该反应在室温下可能自发 | |
| D. | 不能确定该反应能否自发进行 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 化学键 | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | 413.4 | 436.0 | 351.0 | 745.0 | 462.8 |
| A. | -46.2 kJ•mol-1 | B. | +46.2 kJ•mol-1 | C. | -181.6 kJ•mol-1 | D. | +181.6 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com