
科目: 来源: 题型:选择题
| A. | SO2、Cl2均能使品红溶液褪色 | |
| B. | NH4Cl晶体、固态碘受热时均能变成气体 | |
| C. | 苯酚,乙烯均能使溴水褪色 | |
| D. | 福尔马林,葡萄糖与新制的Cu(OH)2共热均有红色沉淀 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 质量均为mg的H2SO4和H3PO4中含有的电子数均为50mNA/98 | |
| B. | 标准状况下,1升辛烷完全燃烧后,所生成气态产物的分子数为8NA/22.4个 | |
| C. | 在1L0.5mol•L-1的Na2CO3溶液中,离子总数一定大于1.5NA个 | |
| D. | 1mol H2O2与MnO2充分作用下转移的电子总数为NA个 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | G4H10的一种同分异构体只能生成一种一氯代物 | |
| B. | CH3-CH=CH-C≡C-CF3分子结构中6个碳原子不可能都在一条直线上 | |
| C. | 某物质的名称为:2-甲基-3-乙基丁烷 | |
| D. | 制取1,2-二溴乙烷的最合理的方法是乙烯与HBr进行加成反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 稳定性:H2O<H2S<HBr<HCl | B. | 氧化性:Cu2+>H+>Fe3+>Na+ | ||
| C. | 酸性:HClO4>H2SO4>H2PO4>H3AsO4 | D. | 半径:K+>Cl->Al3+>Mg2+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2CO3→Na2SiO3 | B. | Si→SiO2 | C. | SiO2→H2SiO3 | D. | CuSO4→CuCl2 |
查看答案和解析>>
科目: 来源: 题型:解答题
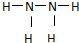 ,过氧化氢的电子式
,过氧化氢的电子式 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化: .
.查看答案和解析>>
科目: 来源: 题型:解答题
 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com