
科目: 来源: 题型:选择题
| 选项 | 化学反应方程式 | 已知条件 | 预测 |
| A | M(s)═X(g)+Y(s) | △H>0 | 它是非自发反应 |
| B | W(s)+xG(g)═20Q(g) | △H<0,自发反应 | x可能等于1、2、3 |
| C | 4X(g)+5Y(g)═4W(g)+6G(g) | 能自发反应 | △H一定小于0 |
| D | 4M(s)+N(g)+2W(l)═4Q(s) | 常温下,自发进行 | △H>0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
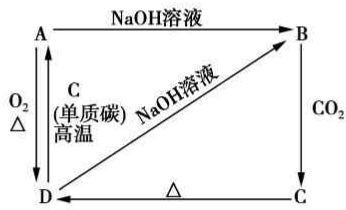 已知A是灰黑色、有金属光泽的固体单质.根据如图所示的物质之间的转化关系,回答下列有关问题. (1)写出B、C两物质的名称:B硅酸钠,C硅酸.
已知A是灰黑色、有金属光泽的固体单质.根据如图所示的物质之间的转化关系,回答下列有关问题. (1)写出B、C两物质的名称:B硅酸钠,C硅酸.查看答案和解析>>
科目: 来源: 题型:填空题
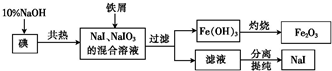
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2:1 | B. | 3:1 | C. | 2:3 | D. | 3:4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 25 | B. | 12 | C. | 48 | D. | 100 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
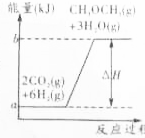 ,工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用进行的,反应器中发生了下列反应:
,工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用进行的,反应器中发生了下列反应:查看答案和解析>>
科目: 来源: 题型:填空题
 如图所示的装置,接通电源5min后,电极3的质量增加了0.64g.
如图所示的装置,接通电源5min后,电极3的质量增加了0.64g.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 25℃时,NH4Cl和NH3.H2O的混合液中离子浓度可能为C(NH4+)>C(Cl-)>C(OH-)>C(H+) | |
| B. | 向0.1mol/L的CuSO4溶液中加入少量蒸馏水,溶液酸性减弱,Cu2+水解程度降低 | |
| C. | 25℃时,PH=12的NaOH溶液、PH=12的CH3COONa溶液、PH=2的硫酸,三种溶液中水的电离程度相同 | |
| D. | 25℃时,向稀氨水中通入NH3,溶液中C(OH-)减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com