
科目: 来源: 题型:
 某学生用NaOH标准溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用NaOH标准溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:| A | B | C | D | |
| X/mol?L-1 | 0.09 | 0.03 | 0.9 | 0.3 |
| Y/mol?L-1 | 0.03 | 0.09 | 0.3 | 0.9 |
查看答案和解析>>
科目: 来源: 题型:
| 温度/℃ | 400 | 427 | 700 | 800 |
| 平衡常数 | 9.94 | 9 | b | 0.64 |
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| H | + 4 |
查看答案和解析>>
科目: 来源: 题型:
 (1)某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如下图所示.由图中数据分析,该反应的化学方程式为:
(1)某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如下图所示.由图中数据分析,该反应的化学方程式为:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
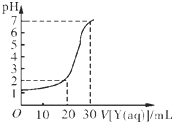
为研究土壤的酸碱性,某学生做了如下实验:将一定体积的蒸馏水加入一定质量的土壤中,充分搅拌后,过滤并留取滤液,测滤液的pH后向滤液中滴加氨水,每加入2mL氨水就搅拌均匀并测量溶液的pH,所得实验记录如下,则所加入氨水的pH为( )
|
查看答案和解析>>
科目: 来源: 题型:
下列物质分别加入水后对水的电离程度的影响都不同的一组是( )
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com