
科目: 来源:2016-2017学年辽宁省高二上期中化学卷(解析版) 题型:选择题
下列说法正确的是
A.常温下,pH=9的碳酸钠溶液中由水电离出的c(OH-)=1×10-9mol·L-1
B.温度相同时,在弱酸溶液和强碱稀溶液中,水的离子积常数Kw相同
C.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
D.中和等体积pH相同的H2SO4和HCl溶液,消耗NaOH的物质的量为2:1
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省高二上期中化学卷(解析版) 题型:选择题
常温下,下列溶液中的微粒浓度关系正确的是
A.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+) – 2c(OH-) = c(CH3COO-) – c(CH3COOH)
B.pH = 8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-) > c(H2CO3)
C.pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl-) = c(NH4+) > c(OH‑) = c(H+)
D.新制氯水中加入固体NaOH:c(Na+) = c(Cl-) + c(ClO-) + c(OH‑)
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省高二上期中化学卷(解析版) 题型:选择题
体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液,分别加水稀释至体积V,pH随lgV的变化情况如图所示,下列叙述中正确的是
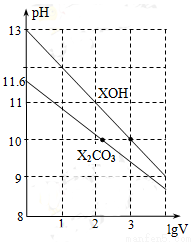
A.XOH是弱碱
B.pH=10的两种溶液中的c(X+):XOH大于X2CO3
C.已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2
D.当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则c(HCO3-)/c(CO32-)减小
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省高二上期中化学卷(解析版) 题型:选择题
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=4×10-10,下列说法不正确的是
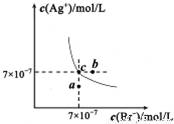
A.在t℃时,AgBr的Ksp为4.9×l0-13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t℃时,AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)平衡常数K≈816
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省高二上期中化学卷(解析版) 题型:选择题
下列有关实验操作、现象及结论的叙述正确的是
A.用钠可以检验某无水酒精中是否含有水
B.除去甲烷中混有的少量乙烯,可以将混合气体通过酸性KMnO4溶液
C.制取乙酸乙酯时,试剂加入的顺序是:先加入乙醇,后慢慢加入浓硫酸,最后加入乙酸
D.在蔗糖溶液中加入少量稀硫酸,水浴加热后,再加入少量新制的氢氧化铜悬浊液,加热至沸腾,没有砖红色沉淀生成,说明蔗糖没有水解
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省高二上期中化学卷(解析版) 题型:选择题
按如图所示的装置进行电解实验。A极是铜镍合金,B极为纯铜,电解质溶液为硫酸铜溶液(足量)。通电一段时间后,A极恰好全部溶解,此时B极质量增加3.2g,溶液质量增加0.05 g,(已知氧化性,Cu2+>Ni2+)则A合金中铜、镍原子个数比为
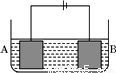
A.4∶1 B.3∶1 C.2∶1 D.1:1
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省高二上期中化学卷(解析版) 题型:选择题
下列实验事实能达到目的的是
编号 | 实验内容 | 实验目的 |
A | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
B | 室温下,用pH试纸测定浓度为0.1 mol·L-1NaClO溶液和0.1 mol·L-1 CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
C | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
D | 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp:Mg(OH)2 >Fe(OH)3 |
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省高二上期中化学卷(解析版) 题型:选择题
t℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为: 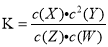 。有关该平衡体系的说法正确的是
。有关该平衡体系的说法正确的是
A.升高温度.平衡常数K一定增大
B.增大压强.W(g)质量分数增加
C.升高温度.若混合气体的平均相对分子质量变小.则正反应是放热反应
D.增大X(g)浓度.平衡向正反应方向移动
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省高二上期中化学卷(解析版) 题型:填空题
燃料电池具有广阔的发展前途,科学家近年研制出一种微型的燃料电池,采用甲醇取代氢气做燃料可以简化电池设计,该电池有望取代传统电池.某学生在实验室利用碱性甲醇燃料电池电解Na2SO4溶液.
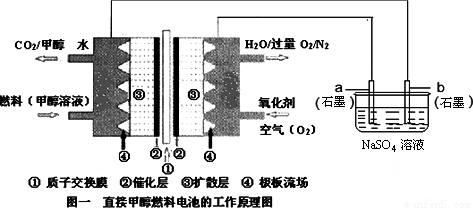
请根据图示回答下列问题:
(1)图中a电极是_____________(填“正极”、“负极”、“阴极”或“阳极”).该电极上发生的电极反应式为__________________.
(2)碱性条件下,通入甲醇的一极发生的电极反应式为________________.
(3)当消耗3.36 L氧气时(已折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是____________mol.
(4)若a、b电极材料分别为铁和石墨,则电解总反应化学方程式为____________
查看答案和解析>>
科目: 来源:2016-2017学年辽宁省高二上期中化学卷(解析版) 题型:实验题
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件多化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下的方案。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/ mol•L-1 | 体积/mL | 浓度/ mol•L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,标况下,每生成89.6L CO2气体,转移 mol 电子。写出H2C2O4与酸性KMnO4溶液反应的离子方程式:
(2)探究温度对化学反应速率影响的实验编号是 (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是 。本实验通过测定 来判断反应的快慢。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______________ mol•L-1•min-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com