
科目: 来源:2017届安徽省六校教育研究会高三上第一次联考化学卷(解析版) 题型:选择题
14g铜、银合金与一定量某浓度的硝酸溶液反应,金属完全溶解,放出的气体与1.12L(标准状况下)氧气混合通入水中,恰好全部被水吸收,则合金中银的质量是
A.2.7g B.5.4g C.8.1g D.10.8g
查看答案和解析>>
科目: 来源:2017届安徽省六校教育研究会高三上第一次联考化学卷(解析版) 题型:推断题
位于前四周期的6种主族元素A、B、C、D、E、F原子序数依次增大,其中B、D同主族, D、E同周期。A、B、C在周期表中相邻,且三种元素的原子最外层电子数之和为18。F是其所在周期中最活泼的金属元素。根据推断回答下列问题:
(1)A在周期表中的位置 ;写出D与F形成的最简单离子化合物的电子式 。
(2)用“>”或“<”填空:
离子半径 | 非金属性 | 酸性 | 沸点 |
F+ D2— | A B | D的最高价氧化物的水化物 | C的氢化物 E的氢化物 |
(3)—定条件,在水溶液中1molE—、EBx—(x=1,2,3,4)的能量(KJ)相对大小如图所示。
①d点对应的微粒是 (填离子符号)。
②b→a+c反应的离子方程式为 ,该反应是 反应(填“吸热”或“放热”)
查看答案和解析>>
科目: 来源:2017届安徽省六校教育研究会高三上第一次联考化学卷(解析版) 题型:填空题
硫酸及其盐在工农业生产中有着重要的应用。
(1)SO2催化氧化为SO3的反应是工业制硫酸的重要过程,①下图是反应过程中SO2和SO3的浓度隨时间t的变化情况。反应从开始到达到平衡时,用O2表示的平均反应速率为 。
②在一容积可变的密闭容器中充入一定量SO2(g)和O2(g),O2的平衡转化率如图所示。则p1与p2的大小关系是p1 p2 (填“>”“<”或“=”);A、B、C三点的平衡常数大小关系为 (用Ka、Kb、Kc表示三点对应的平衡常数)。

(2)生产硫酸过程中产生的尾气,可用氨水吸收,溶液中生成(NH4)2SO4、(NH4)2SO3等溶质。
①(NH4)2SO4溶液呈酸性的原因是 (用离子方程式表示)。
②己知:
NH3·H2O | H2SO3 | |
电离平衡常数 | 1.7×10—5 | Ka1=1.54×10—2 Ka2=1.02×10—7 |
NH4HSO3溶液呈 (填“酸性”、“碱性”、“中性”)。
③25℃时,相同物质的量的SO2与NH3溶于水,所得溶液中c(H+)—c(OH—)= (填序号)。
A.c(SO32—)—c(H2SO3)
B.c(HSO3—)+c(SO32—)—c(NH4+)
C.c(SO32—)+c(NH3·H2O)—c(H2SO3)
D.(HSO3—)+2c(SO32—)—c(NH4+)
(3)己知:①BaSO4(s)+4C(s)=BaS(s)+4CO(g) △H=+571.2kJ•mo1—1
②BaS(s)=Ba(s)+S(s) △H=+460kJ•mo1—1
③2C(s)+O2(g)=2CO(g) △H=—221kJ•mo1—1
则用Ba(s)、S(s)、O2(g)反应生成BaSO4(s)的热化学方程式为 。
查看答案和解析>>
科目: 来源:2017届安徽省六校教育研究会高三上第一次联考化学卷(解析版) 题型:实验题
已知:CH3C1常温下为气态,难溶于水,易溶于乙醇等有机溶剂。实验室制备CH3C1原理为:CH3OH+HCl(浓) CH3Cl(g)+H2O
CH3Cl(g)+H2O
(1)实验步骤如下:
①干燥ZnCl2晶体。实验室干燥ZnCl2晶体制得无水ZnCl2的方法是 。
②称取13.6g研细的无水ZnCl2,量取20mL浓盐酸、一定量的CH3OH,分别放入装置 (填装置编号)的对应仪器中;



装置Ⅰ 装置Ⅱ 装置Ⅲ
③产生的CH3Cl气体,最好选用 (填“向上排空气法”、“向下排空气法”、“排水法”)收集,原因是 。
(2)为探究CH3Cl与CH4分子稳定性的差别,某化学兴趣小组设计实验验证CH3Cl能被强氧化剂酸性高锰酸钾溶液氧化。
①将CH3Cl制备装置中产生的气体依次通过洗气瓶 (填洗气瓶编号),如果观察到 现象则证明CH3C1稳定性弱于CH4。



A.1.5%(H+)KMnO4溶液 B.蒸馏水 C.5%Na2SO3溶液
②洗气瓶A中发生反应的离子方程式: ;
洗气瓶C中发生反应的离子方程式:
③为处理未反应完的CH3C1,还应在上述洗气瓶后接一只盛 (填试剂名称)的洗气瓶。
查看答案和解析>>
科目: 来源:2017届安徽省六校教育研究会高三上第一次联考化学卷(解析版) 题型:填空题
某工厂用回收钒渣(含VOSO4、K2SO4、SiO2))制取V2O5时工艺流程如下:
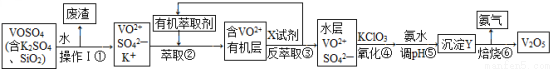
请回答下列问题:
(1)操作I的名称 ,①中产生废渣的主要成分是 。
(2)己知:VOSO4(水层)+2HA(有机层) VOA2(有机层)+H2SO4(水层)。步骤②中必须加入适量碱,其原因是 ;步骤③中反萃取所用的试剂X为 。
VOA2(有机层)+H2SO4(水层)。步骤②中必须加入适量碱,其原因是 ;步骤③中反萃取所用的试剂X为 。
(3)步骤④中的反应的离子方程式:□ClO3—+□VO2++□H+=□VO3++□ +□
(4)沉淀Y的摩尔质量为598g·mol—1,且仅含有四种元素。取59.8g沉淀Y的样品充分焙烧,得到产品54.6g,将产生的气体通过足量碱石灰,碱石灰增重1.8g,剩余的气体再通入稀硫酸被完全吸收。通过计算确定沉淀Y的化学式为 。
(5)钒沉淀率和溶液pH之间关系如下
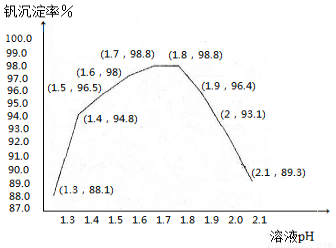
⑤中加入氨水,调节溶液的最佳pH为 ;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。(己知:25℃时,Ksp[Fe(OH)3]=2.6×l0—39)
查看答案和解析>>
科目: 来源:2017届福建省高三上联考一化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.乙烯和甲烷都能发生加成反应
B.米酒变酸是因为乙醇被氧化为乙酸
C.糖类、油脂、蛋白质都属于天然高分子化合物
D.可用热的NaOH溶液除去乙酸乙酯中的乙酸杂质
查看答案和解析>>
科目: 来源:2017届福建省高三上联考一化学卷(解析版) 题型:选择题
2016年6月8日,国际纯粹与应用化学联合会宣布,将合成化学元素第117号(Ts)提名为化学新元素。117号元素是在粒子加速器中,用钙离子轰击放射性元素锫生成的,但很快又衰变成115号元素和113号元素。其中的一种核素为293 117Ts,下列有关叙述正确的是( )
A. 117号元素最高正价应为+7
B. 核素293 117Ts中中子数与质子数之差为176
C. 117号元素衰变成115号元素和113号元素是化学变化
D. 117号与115号元素的原子质量比为117:115
查看答案和解析>>
科目: 来源:2017届福建省高三上联考一化学卷(解析版) 题型:选择题
下列有关实验的选项正确的是( )
A | B | C | D[ |
记录滴定终点 读数为12.20 mL | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | 苯萃取碘水中I2 , 分出水层后的操作 | 观察Fe(OH)2的生成 |
|
|
|
|
查看答案和解析>>
科目: 来源:2017届福建省高三上联考一化学卷(解析版) 题型:选择题
用NA代表阿伏加德罗常数的值,下列叙述正确的是( )
A.标况下,11.2L CO和N2混合气体中含有的原子数是NA
B.100 g 98%的浓硫酸中,氧原子总数为4NA
g 98%的浓硫酸中,氧原子总数为4NA
C.1 mol·L-1的NaClO溶液中含有ClO 的数目小于NA
的数目小于NA
D.1 mol SO2与足量O2在一定条件下反应生成SO3 ,共转移2NA个电子
查看答案和解析>>
科目: 来源:2017届福建省高三上联考一化学卷(解析版) 题型:选择题
下列叙述中,正确的是( )
A.钢铁腐蚀的负极反应为:Fe-3e- = Fe3+
B.碱性介质甲烷燃料电池的正极反应为:O2+2H2O+4e-=4OH-
C.Mg — Al及NaOH溶液构成的原电池中负极材料为Mg
D.氯碱工业中阳极上产生的气体比阴极上产生的气体多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com