
科目: 来源:2016-2017学年贵州省高二上期中化学卷(解析版) 题型:选择题
在一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O2 2NO,经测定前3 s用N2表示的反应速率为0.1 mol·L-1·s-1,则6 s末NO的浓度为 ( )
2NO,经测定前3 s用N2表示的反应速率为0.1 mol·L-1·s-1,则6 s末NO的浓度为 ( )
A.1.2 mol·L-1 B.大于1.2 mol·L-1
C.小于1.2 mol·L-1 D.不能确定
查看答案和解析>>
科目: 来源:2016-2017学年贵州省高二上期中化学卷(解析版) 题型:选择题
如图是关于反应A2(g)+3B2(g)  2C(g)(正反应为放热反应)的平衡移动图形,影响平衡移动的原因是( )
2C(g)(正反应为放热反应)的平衡移动图形,影响平衡移动的原因是( )
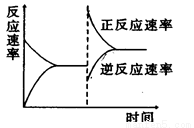
A.升高温度,同时加压
B.降低温度,同时减压
C.增大反应物浓度,同时使用适宜的催化剂
D.增大反应物浓度,同时减小生成物浓度
查看答案和解析>>
科目: 来源:2016-2017学年贵州省高二上期中化学卷(解析版) 题型:选择题
反应X(g)+Y(g) 2Z(g) ΔH<0,达到平衡时,下列说法正确的是( )
2Z(g) ΔH<0,达到平衡时,下列说法正确的是( )
A.降低温度,Y的转化率增大 B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大 D.减小容器体积,平衡向右移动
查看答案和解析>>
科目: 来源:2016-2017学年贵州省高二上期中化学卷(解析版) 题型:选择题
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)=CO2(g) △H1 C(s)+1/2O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H3 S(g)+O2(g)=SO2(g) △H4
③H2(g)+1/2O2(g)=H2O(l) △H5 2H2(g)+O2(g)=2H2O(l) △H6
④CaCO3(s)=CaO(s)+CO2(g) △H7 CaO(s)+H2O(l)=Ca(OH)2(s) △H8
A.① B.④ C.②③④ D.①②③
查看答案和解析>>
科目: 来源:2016-2017学年贵州省高二上期中化学卷(解析版) 题型:选择题
一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3mol·L-1、0.08 mol·L-1,则下列判断正确的是 ( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3mol·L-1、0.08 mol·L-1,则下列判断正确的是 ( )
A.c1∶c2=3∶1
B.X、Y的转化率不相等
C.平衡时,Y和Z的生成速率之比为2∶3
D.c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1
查看答案和解析>>
科目: 来源:2016-2017学年贵州省高二上期中化学卷(解析版) 题型:选择题
一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是 ( )
CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是 ( )
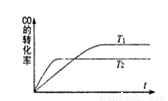
A.T1>T2
B.该反应的△H >0
C.T1时的平衡常数K1> T2时的平衡常数K2
D.T1时的平衡常数K1< T2时的平衡常数K2
查看答案和解析>>
科目: 来源:2016-2017学年贵州省高二上期中化学卷(解析版) 题型:选择题
COCl2(g)  CO(g) + Cl2(g) ΔH > 0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是 ( )
CO(g) + Cl2(g) ΔH > 0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是 ( )
① ② ③ ④
A.①表示随温度升高,平衡常数的变化
B.②表示加入催化剂,反应速率随时间的变化
C.③表示恒压条件下,反应物的转化率随充入惰性气体体积的变化
D.④表示CO的体积分数随充入Cl2量的变化
查看答案和解析>>
科目: 来源:2016-2017学年贵州省高二上期中化学卷(解析版) 题型:选择题
已知下列两个热化学方程式:
2H2(g)+O2(g)= 2H2O(l);ΔH=-571.6kJ/mol
C3H8(g)+5O2(g)= 3CO2(g)+4H2O(l);ΔH=-2220kJ/mol
实验测得氢气和丙烷的混合气体共0. 5mol,完全燃烧时放出热量723.2kJ,则混合气体中氢气和丙烷的体积比约为( )
5mol,完全燃烧时放出热量723.2kJ,则混合气体中氢气和丙烷的体积比约为( )
A.2∶3 B.3∶2 C.1∶3 D.3∶1
查看答案和解析>>
科目: 来源:2016-2017学年贵州省高二上期中化学卷(解析版) 题型:选择题
3molA和2.5molB混合于容积为2L的容器内,使它们发生反应2A(s)+3B(g) 2C(g)+D(g),经过5min生成0.5molD,下列说法正确的是( )
2C(g)+D(g),经过5min生成0.5molD,下列说法正确的是( )
A.B的平均消耗速率为0.3mol/(L min)
min)
B.若反应容器内气体的密度不再发生变化,说明反应已经达到平衡
C.平衡后,增大压强,平衡将向正反应方向移动
D.C的平衡浓度为2mol/L
查看答案和解析>>
科目: 来源:2016-2017学年贵州省高二上期中化学卷(解析版) 题型:填空题
氨气是重要的化工原料
(1)已知: N2(g)+O2(g)= 2NO(g) △H = +180.5kJ·mol-1
4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H = -905kJ·mol-1
2H2(g)+O2(g)= 2H2O(g) △H = -483.6kJ·mol-1
写出氨气在高温高压催化剂条件下生成氮气和氢气的热化学方程式:
;如果在1L密闭容器中,3mol NH3 在等温条件下充分反应,2min后达到平衡,平衡时的反应热为92.4kJ ,则在这段时间内v(H2)= ;保持温度不变,将起始NH3的物质的量调整为8mol,平衡时NH3的转化率为  。
。
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
A.增大压强 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com