
科目: 来源:2017四川省自贡市高三第一次诊断考试化学试卷(解析版) 题型:选择题
X、Y、Z、W、Q是原子序教依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体, X、Y、W在周期表中的相对位里关系如图.下列说法正确的是
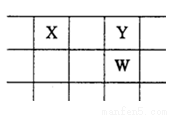
A. 五种元素中,原子半径最大的是W
B. Y的氢化物的沸点比W的氢化物的沸点低
C. Y与Z 形成的化合物都可以和盐酸反应
D. Z与Q形成的化合物的水解液一定显酸性
查看答案和解析>>
科目: 来源:2017四川省自贡市高三第一次诊断考试化学试卷(解析版) 题型:选择题
用下图装置制取、提纯并收集下表中的四种气体(a、b、c、d表示相应仪器中加入的试剂,收集装置略去)。其中可行的是
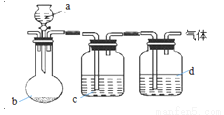
气体 | a | b | c | d | |
A |
| 稀硫酸 | 石灰石 | 饱和 | 浓 |
B |
| 浓盐酸 |
| 饱和 | 浓 |
C |
| 饱和 | 消石灰 |
| 碱石灰 |
D |
| 硝酸 | 锌粒 |
|
|
查看答案和解析>>
科目: 来源:2017四川省自贡市高三第一次诊断考试化学试卷(解析版) 题型:选择题
氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是:
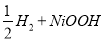
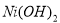 据此反应式判断,下列叙述中不正确的是
据此反应式判断,下列叙述中不正确的是
A. 电池放电时,电池负极周围溶液的PH不断增大
B. 电池放电时,正极的电极反应为: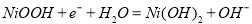
C. 电池充电时,阳极周围溶液的的PH不断减小
D. 电池充电时,阴极的电极反应为:2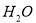 +2
+2
查看答案和解析>>
科目: 来源:2017四川省自贡市高三第一次诊断考试化学试卷(解析版) 题型:选择题
下列项目判断,结论正确的是
选项 | 项目 | 结论 |
A | 三种有机化合物:乙烷、氯乙烯、苯 | 分子内所有原子均在同一平面上 |
B | C4H8Cl2的同分异构体数目(不考虑立体异构) | 共有10种 |
C | 乙烯和苯都能使溴水褪色 | 褪色的原理相同 |
D | 由乙酸和乙醇制乙酸乙酯,油脂水解 | 均属于取代反应 |
查看答案和解析>>
科目: 来源:2017四川省自贡市高三第一次诊断考试化学试卷(解析版) 题型:选择题
有机化合物A的分子式是C13H20O8(相对分子质量为304),1molA在酸性条件下与4mol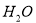 反应得到4molCH3COOH和1molB.下列说法错误的是
反应得到4molCH3COOH和1molB.下列说法错误的是
A. A和B的相对分子质量之差为168
B. B一定不能发生加成反应
C. 有机物B与CH3CH2OH互为同系物
D. 分子式为C5H1002且与CH2COOH属于同类物质的有机物只有4种
查看答案和解析>>
科目: 来源:2017四川省自贡市高三第一次诊断考试化学试卷(解析版) 题型:实验题
氰化钠(NaCN)是一种重要的化工原料、有剧毒,一旦泄露可以通过喷洒双氧水或硫代硫酸钠溶液来处理。
已知:氰化钠与硫代硫酸钠的反应为:NaCN+Na2S2O3==NaSCN+Na2SO3回答下列问题:
(1)氰化物中碳的化合价为___________;用硫代硫酸钠处理1mol NaCN时,反应中转移电子的物质的量为 。
(2) NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是 。
(3)某化学兴趣小组在实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】制备Na2S2O3,其实验室装置如下:

b装置的作用是___________;c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有_____________。
实验结束后,在e处最好连接盛____________(填化学式)的注射器,再关闭K2打开K1,以防拆除装置过程中的有害气体污染空气。
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg/L;
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先于Ag+反应。
实验如下:取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
滴定时1.000×10-4mol/L的标准AgNO3溶液应用_________(填仪器名称)盛装;滴定终点时的现象是___________。
处理后的废水是否达到排放标准:__________(填“是”或“否”),其依据是__________(用实验数据说明)。
查看答案和解析>>
科目: 来源:2017四川省自贡市高三第一次诊断考试化学试卷(解析版) 题型:填空题
甲醇是重要的绿色能源之一,目前科学家用水煤气(CO+H2)合成甲醇,其反应为:
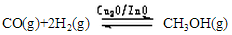 △H=-128.1kJ·mol-1,回答下列问题:
△H=-128.1kJ·mol-1,回答下列问题:
(1)该反应是可逆反应,为使化学反应速率和CO的转化率都同时提高的措施有_____________(写两条)。
(2)恒温恒容条件能说明该可逆反应达平衡的是______________;
A.2v正(H2)=v逆(CH3OH)
B.n(CO):n(H2):n(CH3OH)=1:2:1
C.混合气体的密度不变
D.混合气体的平均相对分子质量不变
(3)若上述可逆反应在恒温恒容的密闭容器进行,起始时间向该容器中冲入1molCO(g)和2molH2(g)。实验测得H2的平衡转化率随温度(T)、压强(P)的变化如图所示。

该反应的△S____________0,图中的T1___________T2(填“<”“>”或“=”)
②T1下到达平衡状态A时,容器的体积为2L,此时该反应的平衡常数为_____________,若达到平衡状态B时,则容器的体积V(B)=________L。
(4)已知:H2(g)燃烧热△H=-285.8kJ·mol-1、和CO(g)燃烧热△H=-283.0kJ·mol-1,则CH3OH(g)燃烧热的热化学方程式是为____________。
查看答案和解析>>
科目: 来源:2017四川省自贡市高三第一次诊断考试化学试卷(解析版) 题型:填空题
从某废液(含有Fe2+、Cu2+、Cl-)中回收铜并制得纯净的FeCl3溶液。现以制得纯净的FeCl3溶液为原料制取优良的水处理剂高铁酸钾(K2FeO4),其流程如下:

已知:高锰酸钾(K2FeO4)位暗紫色固体,可溶于水。在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。高锰酸钾具有强氧化性。高锰酸钾(K2FeO4)与水作用产生Fe(OH)3。
(1)检验废液中含有Fe2+选用的试剂是________(填化学式);从废液中制得纯净的FeCl3溶液加入的试剂除铁粉外,还需要一种试剂是_________(填化学式),加入时发生反应的离子方程式为__________。
(2)高锰酸钾(K2FeO4)在处理水过程中的作用是_________和__________。
(3)“氧化”过程反应的离子方程式为__________。
(4)过滤时需用的玻璃仪器有玻璃棒、烧杯和________,上述工艺得到的高锰酸钾常含有杂志,可用重结晶法提纯,操作是:将粗产品用_________溶解,然后________。
(5)用回收的铜为原料可制得粗制CuSO4·5H2O晶体(含有少量的FeSO4·7H2O),除去CuSO4·5H2O晶体中杂志的方法是:向溶液中加入H2O2,再调解溶液PH,过滤即可制得纯净的CuSO4溶液,进而制得纯净CuSO4·5H2O的晶体。
已知:室温时一些物质的Kaq如下表:
化学式 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
Kaq | 8.0×10-16 | 8.0×10-18 | 8.0×10-20 |
已知溶液中的离子浓度小于1×10-6mol·L-1时就认定沉淀完全。
加双氧水的目的是__________;若溶液中CuSO4的浓度为3.0mol·L-1,通过计算说明此方法可除去粗制CuSO4·5H2O晶体中FeSO4·7H2O的理由________。
查看答案和解析>>
科目: 来源:2017四川省自贡市高三第一次诊断考试化学试卷(解析版) 题型:推断题
已知由短周期常见元素形成的纯净物A、B、C、D转化关系如图1琐事,物质A与物质B之间的反应不再溶液中进行。

若A为金属单质,C是淡黄色固体,D是一元强碱。
①物质B是__________(填化学式)。
②化合物C的电子式为_________;化合物D中所含化学键的类型是_________。
③在常温下,向PH=a的醋酸溶液中加入等体积pH=b的D溶液,且a+b=14,则充分反应后,所得溶液中各种离子的浓度由大到小的顺序是:__________.
(2)若A为非金属单质,C是有色气体,D是一元强酸.
①B为__________(填化学式)。
②化合物C与H2O反应化学方程式___________,氧化剂与还原剂的量比为_________。
(3)某同学用图2装置完成有关探究实验。
Ⅰ试管中发生反应的离子方程式为__________。
Ⅱ试管中观察到__________的实验现象时,说明NO2能溶于浓硫酸中,浓硫酸不能干燥NO2。
查看答案和解析>>
科目: 来源:2017四川省自贡市高三第一次诊断考试化学试卷(解析版) 题型:填空题
已知二元酸H2A在水中存在以下电离:H2A==H++HA-,HA- H++A2-,回答下列问题:
H++A2-,回答下列问题:
(1)Na2A溶液呈________性,理由是___________(用离子方程式表示)。
(2)NaHA溶液呈________性,理由是___________。
(3)0.1mol/L的NaHA溶液的PH=3,则Ka(HA-)=_____________。
(4)某温度下,向10 mL 0.1 mol/L NaHA溶液中加入0.1 mol/L KOH溶液V mL至溶液中水的离子积常数Ka=c2(OH-),此时溶液呈___________性,V____________10 (填“<”“>”或“=”)c(K+)/c(Na+) ____________1(填“<”“>”或“=”),溶液中电荷守恒等式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com