
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| O | - 3 |
查看答案和解析>>
科目: 来源: 题型:
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |
| C(CO2).C(H2) |
| C(CO).C(H2O) |
| C(CO2).C(H2) |
| C(CO).C(H2O) |
| K2 |
| K1 |
| K2 |
| K1 |

查看答案和解析>>
科目: 来源: 题型:
| 阳离子 | Na+、K+、Cu2+ | ||
| 阴离子 | SO
|

| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
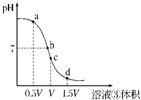 常温下,浓度均为0.1mol/L的四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水
常温下,浓度均为0.1mol/L的四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水查看答案和解析>>
科目: 来源: 题型:
 反应N2O4(g)?2NO2(g);△H=+57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
反应N2O4(g)?2NO2(g);△H=+57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )查看答案和解析>>
科目: 来源: 题型:
| 放电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com