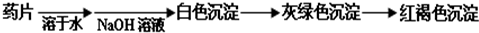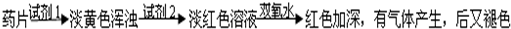常见的治疗缺铁性贫血的方法是服用补铁药物,市场上一种常见的补铁药物的商品名称是:速力菲,正式名称是:琥珀酸亚铁薄膜片,为棕黄色薄膜衣片,除去薄膜衣后显暗黄色,药片中Fe
2+的含量约为34.0%~36.0%.该药片在水和乙醇中的溶解度不大.某学校化学实验小组为了检测“速力菲”药片中Fe
2+的存在,设计了如下几组理论实验设计方案:
Ⅰ.甲组方案:
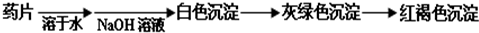
(提示:白色的Fe(OH)
2在空气中会迅速变成灰绿色,最后变成红褐色)
甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果.分析甲组实验失败的可能原因:
该药片在水中溶解度不大,少量溶解后的溶液中几乎不存在Fe2+离子,所以得不到预期的实验现象.
该药片在水中溶解度不大,少量溶解后的溶液中几乎不存在Fe2+离子,所以得不到预期的实验现象.
.
Ⅱ.乙组同学在参考书上查得如下资料:
①人体胃液中有大量盐酸,能溶解多种物质.
②H
2O
2不稳定,光照、加热和微量杂质会促使其分解;H
2O
2中氧元素为-1价,它既有氧化性又有还原性.
他们认真思考了甲组实验失败的原因,模拟药服用后在人体中溶解的变化过程,重新设计并完成下列实验:
乙组方案:
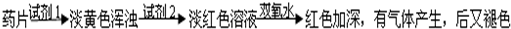
(1)试剂1为:
盐酸
盐酸
,试剂2为:
KSCN溶液
KSCN溶液
;
(2)加入试剂2后,溶液显淡红色的原因是:
在溶液形成过程中有少量Fe2+已经氧化成Fe3+离子,滴加KSCN溶液后,Fe3+离子与SCN-离子结合成浓度较小的红色[Fe(SCN)]2+络离子.
在溶液形成过程中有少量Fe2+已经氧化成Fe3+离子,滴加KSCN溶液后,Fe3+离子与SCN-离子结合成浓度较小的红色[Fe(SCN)]2+络离子.
;
(3)加双氧水后,红色加深的原因是:
加入的H2O2能将Fe2+氧化为Fe3+,导致溶液中Fe3+浓度增大,[Fe(SCN)]2+络离子浓度也随之增大,所以红色加深.
加入的H2O2能将Fe2+氧化为Fe3+,导致溶液中Fe3+浓度增大,[Fe(SCN)]2+络离子浓度也随之增大,所以红色加深.
.根据氧化还原反应中化合价变化情况,试写出在酸性条件下Fe
2+与双氧水反应的离子方程式:
H2O2+2Fe2++2H+=2Fe3++2H2O
H2O2+2Fe2++2H+=2Fe3++2H2O
.
Ⅲ.丙组同学对乙组实验中最后红色褪去的现象产生了浓厚的兴趣,欲探究其褪色的原因.根据粒子的组成,他们认为有两种可能原因:①[Fe(SCN)]
2+中的三价铁被还原为亚铁;②
SCN-被双氧水氧化
SCN-被双氧水氧化
.
请你对其中一种可能进行实验验证:
实验方案(用文字叙述):
在褪色后溶液中加入FeCl3溶液或在褪色后溶液中加入KSCN溶液
在褪色后溶液中加入FeCl3溶液或在褪色后溶液中加入KSCN溶液
.
根据预期现象判断结论:
在褪色后溶液中加入FeCl3溶液现象:变红色结论:褪色原因是因为①;不变红色结论:褪色原因是因为②
或在褪色后溶液中加入KSCN溶液
现象:变红色结论:褪色原因是因为②;不变红色结论:褪色原因是因为①
在褪色后溶液中加入FeCl3溶液现象:变红色结论:褪色原因是因为①;不变红色结论:褪色原因是因为②
或在褪色后溶液中加入KSCN溶液
现象:变红色结论:褪色原因是因为②;不变红色结论:褪色原因是因为①
.