
科目: 来源: 题型:阅读理解

| ||
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

查看答案和解析>>
科目: 来源: 题型:
 氮化硅是一种新型陶瓷材料,它可由石英晶体与焦炭颗粒在高温的氮气流中,通过如下反应制得:3SiO2+6C+2N2
氮化硅是一种新型陶瓷材料,它可由石英晶体与焦炭颗粒在高温的氮气流中,通过如下反应制得:3SiO2+6C+2N2 Si3N4+6CO,该反应过程中的能量变化如图所示;回答下列问题:
Si3N4+6CO,该反应过程中的能量变化如图所示;回答下列问题:查看答案和解析>>
科目: 来源: 题型:
 (1)我国首创的海洋电池,总反应为:4Al+3O2+6H2O=4Al(OH)3,负极为:
(1)我国首创的海洋电池,总反应为:4Al+3O2+6H2O=4Al(OH)3,负极为:查看答案和解析>>
科目: 来源: 题型:
| a | |||||||
| e | g | i | j | ||||
| b | c | d | f | h | k | l | |
查看答案和解析>>
科目: 来源: 题型:




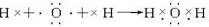
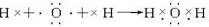






查看答案和解析>>
科目: 来源: 题型:
| 实验 | 实验目的 | 实验内容 |
| Ⅰ | 探究Mg、Al的金属性强弱 | 1将除去氧化膜的镁条和铝条分别投入稀盐酸中 2将除去氧化膜的镁条和铝条分别放入试管中,加入 少量水,加热至沸腾,再向溶液中滴加酚酞溶液 3向MgCl2和AlCl3溶液中分别加氨水至过量 |
| Ⅱ | 探究Cl、S的非金属性强弱 | ④分别加热密封于玻璃管中的H2S和HCl气体 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com